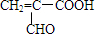题目内容
2.运用元素周期律分析下面的推断,其中正确的是( )| A. | 第IIIA的铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气 | |
| B. | 第VIIA的砹(At)为有色固体,易溶于四氯化碳,但难溶于水 | |
| C. | 第IIA的锶的硫酸盐(SrSO4)是易溶于水的白色固体 | |
| D. | 第VIA的硒的氢化物(H2Se)是无色、有毒,比H2S稳定的气体 |
分析 A.金属性Ti>Al,Al与碱反应为其特性;
B.第VIIA的单质由气体到固体,颜色加深,难溶于水,易溶于有机溶剂;
C.硫酸钙不溶于水;
D.非金属性S>Se.
解答 解:A.金属性Ti>Al,Al与碱反应为其特性,则第IIIA的铊(Tl)只能与盐酸作用产生氢气,不能跟NaOH溶液反应放出氢气,故A错误;
B.第VIIA的单质由气体到固体,颜色加深,难溶于水,易溶于有机溶剂,则第VIIA的砹(At)为有色固体,易溶于四氯化碳,但难溶于水,故B正确;
C.硫酸钙不溶于水,可知第IIA的锶的硫酸盐(SrSO4)是难溶于水的白色固体,故C错误;
D.非金属性S>Se,则VIA的硒的氢化物(H2Se)是无色、有毒,不如H2S稳定的气体,故D错误;
故选B.
点评 本题考查周期律和周期表的综合应用,为高频考点,把握元素的位置和性质、同主族性质变化规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后,又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A. | CH4 | B. | C3H6 | C. | C2H6 | D. | C3H8 |
13.某无色溶液中,若加入溴水,溴水褪色,若加入NH4Cl固体加热,产生刺激性气味的气体,则该溶液中大量存在的离子可能是( )
| A. | Fe3+、Mg2+、S2-、Cl- | B. | H+、Na+、SO42-、NO3- | ||
| C. | K+、Ba2+、OH、SO32- | D. | Na+、K+、Cl-、OH- |
14.已知硼元素有两种天然同位素10B和11B,硼元素的原子量为10.80,则10B和11B的原子个数比为( )
| A. | 1:4 | B. | 1:3 | C. | 1:1 | D. | 4:1 |
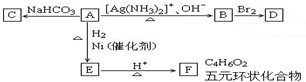 根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)
根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)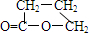 +H2O
+H2O