题目内容
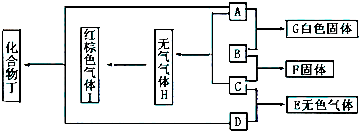
17.以下是有关SO2、Cl2的性质实验.(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?相同(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3.
②SO2通入B中,溶液颜色退去,则该反应的离子方程式 为SO2+I2+2H2O=SO42-+2I-+4H+.
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)B,仍然无法观察到沉淀产生.
A.氨水B.稀盐酸C.硝酸钾溶液D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+.
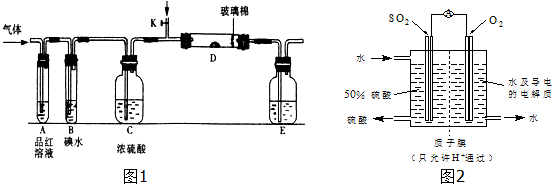
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2电极反应式为SO2-2e-+2H2O=4H++SO42-;电池的总反应式2SO2+O2+2H2O=2H2SO4.
分析 (1)①二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性;SO2在V2O5作催化剂,加热可与O2反应生成SO3;
②SO2与I2能发生氧化还原反应;
(2)SO2在碱性条件下或被氧化成硫酸根,都与氯化钡能产生沉淀;
(3)先根据X中元素的质量之比求出原子个数之比,再根据题中反应现象判断该反应生成的离子,由氧化还原反应写出离子方程式;
(4)SO2来制备硫酸,SO2被氧化,作还原剂,据此判断电极和书写电极反应.
解答 解:(1)①二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性,所以A中观察到的现象相同;SO2在V2O5作催化剂,加热可与O2反应生成SO3,化学方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,
故答案为:相同;2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
②SO2与I2能发生氧化还原反应,从而使碘水颜色褪去,离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(2)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应:
A、氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,故A不符合;
B、稀盐酸加入后不反应,故B符合;
C、加入硝酸钾溶液,硝酸根和氢离子形成稀硝酸具有氧化性,能氧化二氧化硫为硫酸,硫酸根和钡离子生成沉淀,故C不符合;
D、加入硫化钠溶液,硫离子具有还原性,二氧化硫具有氧化性,会反应氧化还原反应,生成硫单质,故D不符合;
故答案为:B.
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3,所以X中S和O的原子个数比为 $\frac{4}{32}$:$\frac{3}{16}$=3:2,所以该离子为S2O3 2-;氯气有强氧化性,能和硫代硫酸根离子发生氧化还原反应,根据题意知,该反应中有硫酸根离子生成,所以氯气中氯元素得电子生成氯离子,所以该反应的离子方程式为:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,
故答案为:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+;
(4)SO2来制备硫酸,SO2被氧化,作还原剂,所以SO2在负极反应,其电极反应式为SO2-2e-+2H2O=SO42-+4H+;SO2制备硫酸,O2作氧化剂,电池的总反应式为2SO2+O2+2H2O=2H2SO4,
故答案为:SO2-2e-+2H2O=SO42-+4H+;2SO2+O2+2H2O=2H2SO4.
点评 本题主要考查了二氧化硫的性质,涉及氧化还原反应、电化学知识,有一定的综合性,中等难度,解题时注意基础知识的运用和化学用语的规范表达.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案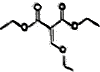 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )| A. | 乙氧基甲叉丙二酸的化学式为C6H6O5 | |
| B. | 1mol乙氧基甲叉丙二酸二乙酯在酸性条件下水解得到1mol乙醇 | |
| C. | 1mol乙氧基甲叉丙二酸最多能消耗2molNaOH | |
| D. | 乙氧基甲叉丙二酸既能发生取代反应又能发生氧化反应 |
 在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有-OH,可能发生的反应有( )| A. | ②④ | B. | ①③④⑤⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的化学性质基本相同 | |
| C. | 14C和14N的质量数相等,它们的中子数不等 | |
| D. | 6Li和7Li的电子数相等,中子数也相等 |
| A. | 第IIIA的铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气 | |
| B. | 第VIIA的砹(At)为有色固体,易溶于四氯化碳,但难溶于水 | |
| C. | 第IIA的锶的硫酸盐(SrSO4)是易溶于水的白色固体 | |
| D. | 第VIA的硒的氢化物(H2Se)是无色、有毒,比H2S稳定的气体 |
| A. | NO与O2在反应生成NO2 | B. | 硝酸工厂用NH3氧化制NO | ||
| C. | 雷雨时空气中的N2转化为NO | D. | 由NH3制碳酸氢铵和硫酸铵 |

| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④b口进气可收集CO2等气体 |
 ;
; ;
; ;
; ;
; ;
; ;
;