题目内容
13.某无色溶液中,若加入溴水,溴水褪色,若加入NH4Cl固体加热,产生刺激性气味的气体,则该溶液中大量存在的离子可能是( )| A. | Fe3+、Mg2+、S2-、Cl- | B. | H+、Na+、SO42-、NO3- | ||
| C. | K+、Ba2+、OH、SO32- | D. | Na+、K+、Cl-、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Fe3+为黄色,与无色不符,且Fe3+、S2-发生氧化还原反应,不能共存,故A错误;
B.该组离子之间不反应,可大量共存,但与溴水不反应,与氯化铵不反应,故B错误;
C.Ba2+、SO32-结合生成沉淀,不能共存,故C错误;
D.该组离子之间不反应,可大量共存,且离子均为无色,OH-与溴水反应褪色,若加入NH4Cl固体加热,产生刺激性气味的气体氨气,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
4.某化合物的结构(键线式)及球棍模型如下:

该有机物分子的1H核磁共振谱如下(单位是ppm).

下列关于该有机物的叙述不正确的是( )

该有机物分子的1H核磁共振谱如下(单位是ppm).

下列关于该有机物的叙述不正确的是( )
| A. | 该有机物分子中不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 该有机物可发生水解反应 |
1.常温下,用0.1mol•L-1的CH3COOH溶液滴定20mL 0.1mol•L-1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1{K}_{a}-2}$ | ||
| C. | Ka=$\frac{2×1{0}^{-7}}{V+20}$ | D. | Ka=$\frac{2×1{0}^{-8}}{V}$ |
8.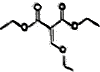 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )| A. | 乙氧基甲叉丙二酸的化学式为C6H6O5 | |
| B. | 1mol乙氧基甲叉丙二酸二乙酯在酸性条件下水解得到1mol乙醇 | |
| C. | 1mol乙氧基甲叉丙二酸最多能消耗2molNaOH | |
| D. | 乙氧基甲叉丙二酸既能发生取代反应又能发生氧化反应 |
18.下列叙述正确的是( )
| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | 白磷在空气中加热到一定温度能转化为红磷 | |
| C. | 光化学烟雾不会引起呼吸道疾病 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
5.有机物 在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有-OH,可能发生的反应有( )
 在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有-OH,可能发生的反应有( )| A. | ②④ | B. | ①③④⑤⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
2.运用元素周期律分析下面的推断,其中正确的是( )
| A. | 第IIIA的铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气 | |
| B. | 第VIIA的砹(At)为有色固体,易溶于四氯化碳,但难溶于水 | |
| C. | 第IIA的锶的硫酸盐(SrSO4)是易溶于水的白色固体 | |
| D. | 第VIA的硒的氢化物(H2Se)是无色、有毒,比H2S稳定的气体 |