题目内容
下列叙述正确的是( )
| A、由石墨比钢石稳定可知:C(金钢石,s)═C(石黑,s)△H>0 | ||
| B、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | ||
| C、等量H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 | ||
D、已知C(s)+O2(g)═CO2(g)△H1,C(s)+
|
考点:反应热的大小比较
专题:
分析:A、物质具有的能量越低越稳定;
B、△H的大小只与反应物生成物的能量有关,和温度有关,与反应途径无关;
C、液态水所含能量比气体水少,△H=Q(生成物的能量和)-Q(反应物的能量和),据此分析;
D、相同物质的量的C完全燃烧放出的热量多.
B、△H的大小只与反应物生成物的能量有关,和温度有关,与反应途径无关;
C、液态水所含能量比气体水少,△H=Q(生成物的能量和)-Q(反应物的能量和),据此分析;
D、相同物质的量的C完全燃烧放出的热量多.
解答:
解:A、能量越低越稳定,石墨能量低,则C(金刚石,s)═C(石墨,s)△H<0,故A错误;
B、△H=Q(生成物的能量和)-Q(反应物的能量和),与反应过程无关,但是和反应条件故有关,故B正确;
C、液态水所含能量比气体水少,△H=Q(生成物的能量和)-Q(反应物的能量和),所以,生成液态水放出热量多,故C错误;
D、相同物质的量的C完全燃烧放出的热量多,所以,生成CO2放出的热量比生成CO放出的热量多,放热△H为负值,△H1<△H2,故D错误;
故选B.
B、△H=Q(生成物的能量和)-Q(反应物的能量和),与反应过程无关,但是和反应条件故有关,故B正确;
C、液态水所含能量比气体水少,△H=Q(生成物的能量和)-Q(反应物的能量和),所以,生成液态水放出热量多,故C错误;
D、相同物质的量的C完全燃烧放出的热量多,所以,生成CO2放出的热量比生成CO放出的热量多,放热△H为负值,△H1<△H2,故D错误;
故选B.
点评:本题考查反应热比较到位,挖掘的比较深,适合学生后期练习.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列液体混合物能用分液漏斗分离的是( )
| A、苯和甲苯 | B、乙醇和水 |
| C、溴乙烷和苯 | D、溴乙烷和水 |
将如图所示实验装置的K闭合,下列判断不正确的是( )
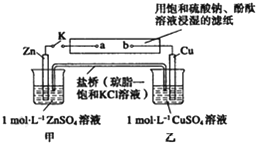

| A、滤纸上a点发生的电极反应为:2H++2e-═H2↑ |
| B、片刻后可观察到滤纸上b点变红色 |
| C、片刻后乙池中c(Cu2+)减小 |
| D、Zn电极上发生氧化反应 |
下列说法或表示方法中正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、由C(金刚石)→C(石墨)△H=-1.9KJ/mol 可知,金刚石比石墨稳定 |
| C、在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8KJ/mol |
| D、向纯水中加入硫酸氢钠,水的电离程度减小,Kw值不变 |
下列叙述正确的是( )
| A、将73gHCl溶于水中配成1L溶液,所得溶液物质的量浓度是2mol/L |
| B、水的摩尔质量是18g |
| C、在标准状况下,1mol任何物质的体积都约为22.4L |
| D、标准状况下,1.8L H2O和1.8L NH3所含分子个数相同 |