题目内容
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应的离子方程式是: .
(2)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-a KJ?mol-1.请写出B与C的稀溶液反应的热化学方程式 .
(3)写出E溶液与过量的B溶液反应的离子方程式 .
(4)在100mL0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到的沉淀的物质的量为 .
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应的离子方程式是:
(2)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-a KJ?mol-1.请写出B与C的稀溶液反应的热化学方程式
(3)写出E溶液与过量的B溶液反应的离子方程式
(4)在100mL0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到的沉淀的物质的量为
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题,离子反应专题
分析:A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,Na2CO3和可溶性的铝盐反应的实质是:铝离子和碳酸根离子之间双水解反应,产物既有沉淀又有气体,所以A是碳酸钠,B是氢氧化钡,碳酸钠和酸反应会产生二氧化碳气体,③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,C是盐酸,E为硫酸铝;
(1)C溶液逐滴加入等体积、等物质的量的浓度的A溶液中中,HCl与碳酸钠反应生成NaHCO3和氯化钠;
(2)氢氧化钡为强碱,盐酸为强酸,结合生成1molH2O(1)的△H=-a KJ?mol-1来分析;
(3)硫酸铝和过量的氢氧化钡反应,硫酸铝全部反应,铝离子和硫酸根之间按照物质的量之比是2:3进行反应;
(4)硫酸铝和氢氧化钠反应生成氢氧化铝的量和氢氧化钠的量的多少有关.
(1)C溶液逐滴加入等体积、等物质的量的浓度的A溶液中中,HCl与碳酸钠反应生成NaHCO3和氯化钠;
(2)氢氧化钡为强碱,盐酸为强酸,结合生成1molH2O(1)的△H=-a KJ?mol-1来分析;
(3)硫酸铝和过量的氢氧化钡反应,硫酸铝全部反应,铝离子和硫酸根之间按照物质的量之比是2:3进行反应;
(4)硫酸铝和氢氧化钠反应生成氢氧化铝的量和氢氧化钠的量的多少有关.
解答:
解:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,Na2CO3和可溶性的铝盐反应的实质是:铝离子和碳酸根离子之间双水解反应,产物既有沉淀又有气体,所以A是碳酸钠,B是氢氧化钡,碳酸钠和酸反应会产生二氧化碳气体,③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,C是盐酸,E为硫酸铝;
(1)C溶液逐滴加入等体积、等物质的量的浓度的A溶液中中,HCl与碳酸钠反应生成等物质的量的NaHCO3和NaCl,反应的离子方程式为:CO32-+H+=HCO3-;
故答案为:CO32-+H+=HCO3-;
(2)由NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-a KJ?mol-1;氢氧化钡为强碱,盐酸为强酸,则B与C的稀溶液反应的热化学方程式为
Ba(OH)2(aq)+HC1(aq)=
BaC12(aq)+H2O(1)△H=-a KJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2a KJ/mol,
故答案为:
Ba(OH)2(aq)+HC1(aq)=
BaC12(aq)+H2O(1)△H=-a KJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2a KJ/mol,
(3)硫酸铝和过量的氢氧化钡反应,铝离子和硫酸根之间按照物质的量之比是2:3,
即2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓,
故答案为:2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓;
(4)n(Al2(SO4)3)=0.1L×0.1mol/L=0.01mol,
n(NaOH)=0.035L×2mol/L=0.07mol;
则n(Al3+)=0.02mol,n(OH-)=0.07mol,
发生:Al3++3OH-=Al(OH)3↓,
0.02mol 0.06mol 0.02mol
Al(OH)3 +OH-=AlO2-+2H2O,
0.01mol 0.01mol
所以反应后,生成0.01molAl(OH)3;
故答案为:0.01mol.
(1)C溶液逐滴加入等体积、等物质的量的浓度的A溶液中中,HCl与碳酸钠反应生成等物质的量的NaHCO3和NaCl,反应的离子方程式为:CO32-+H+=HCO3-;
故答案为:CO32-+H+=HCO3-;
(2)由NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-a KJ?mol-1;氢氧化钡为强碱,盐酸为强酸,则B与C的稀溶液反应的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2a KJ/mol,
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2a KJ/mol,
(3)硫酸铝和过量的氢氧化钡反应,铝离子和硫酸根之间按照物质的量之比是2:3,
即2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓,
故答案为:2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓;
(4)n(Al2(SO4)3)=0.1L×0.1mol/L=0.01mol,
n(NaOH)=0.035L×2mol/L=0.07mol;
则n(Al3+)=0.02mol,n(OH-)=0.07mol,
发生:Al3++3OH-=Al(OH)3↓,
0.02mol 0.06mol 0.02mol
Al(OH)3 +OH-=AlO2-+2H2O,
0.01mol 0.01mol
所以反应后,生成0.01molAl(OH)3;
故答案为:0.01mol.
点评:本题考查知识点较多,根据离子的共存、离子的性质来推断物质是解答本题的关键,综合性强,难度较大,学生需熟悉水解、热化学反应方程式、离子反应等知识来解答.

练习册系列答案
相关题目
下列离子的检验正确的是( )
| A、某溶液中滴入盐酸,生成无色气体,说明原溶液中一定有CO32- |
| B、某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中一定有Cu2+ |
| C、某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中一定有SO42- |
| D、某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中一定有Cl- |
在200mL某硫酸盐溶液中,含有1.5NA个SO42-,(NA表示阿佛加德罗常数的值)同时含有NA个金属离子,则该硫酸盐的物质的量浓度为( )
| A、1mol/L |
| B、2.5mol/L |
| C、5mol/L |
| D、2mol/L |
0.5L AlCl3溶液中Cl-为1.5mol.则AlCl3溶液的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
下列各组离子在指定溶液中,可能大量共存的是( )
| A、酸性溶液中:Fe2+、Ag+、NO3-、I- |
| B、pH=1的溶液中:Na+、[Al(OH)4]-、K+、SO32- |
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、水电离的c(H+)=10-12mol?L-1的溶液中:Cl-、HCO3-、NH4+、SO32- |
下列说法正确的是( )
| A、乙烯和苯都能使溴水褪色,退色的原因相同 |
B、用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和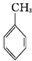 |
| C、乙炔既能使溴水退色,又能使酸性KMnO4溶液退色 |
| D、光照下2,2-二甲基丙烷与Br2反应其一溴取代物有两种 |