题目内容
将25.6g铜与含0.3mol H2SO4的浓硫酸充分反应.
(1)若在反应过程中消耗了0.2mol的H2SO4,则生成的气体标况下体积为多少?
(2)若以上反应产生的气体全部逸出后,继续在剩余物质中加入2mol/L的稀硝酸100mL,充分反应后产生NO的物质的量为多少?
(1)若在反应过程中消耗了0.2mol的H2SO4,则生成的气体标况下体积为多少?
(2)若以上反应产生的气体全部逸出后,继续在剩余物质中加入2mol/L的稀硝酸100mL,充分反应后产生NO的物质的量为多少?
考点:化学方程式的有关计算
专题:计算题
分析:n(Cu)=
=0.4mol,浓硫酸和铜反应方程式为Cu+2H2SO4
CuSO4+SO2↑+2H2O,
(1)根据硫酸和二氧化硫之间的关系式计算;
(2)根据转移电子守恒计算生成NO的物质的量.
| 25.6g |
| 64g/mol |
| ||
(1)根据硫酸和二氧化硫之间的关系式计算;
(2)根据转移电子守恒计算生成NO的物质的量.
解答:
解:n(Cu)=
=0.4mol,浓硫酸和铜反应方程式为Cu+2H2SO4
CuSO4+SO2↑+2H2O,
(1)硫酸和二氧化硫之间的关系式为2H2SO4----SO2,消耗0.2mol硫酸,n(SO2)=
n(H2SO4)=
×0.2mol=0.1mol,则二氧化硫体积=0.1mol×22.4L/mol=2.24L,
答:生成气体在标况下体积为2.24L;
(2)生成二氧化硫需要n(Cu)=
n(H2SO4)=
×0.2mol=0.1mol,还剩余Cu的物质的量为0.3mol,n(HNO3)=2mol/L×0.1L=0.2mol,溶液中剩余硫酸的物质的量是0.3mol-0.2mol=0.1mol,溶液中氢离子的物质的量=0.2mol+0.1mol×2=0.4mol,
根据3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O知,0.4mol氢离子完全反应需要硝酸根离子、铜的物质的量分别是0.1mol、0.15mol,所以铜和硝酸根离子都剩余,根据氢离子计算生成NO的物质的量,根据4H+----NO得生成n(NO)=
×1=0.1mol,
答:生成NO的物质的量是0.1mol.
| 25.6g |
| 64g/mol |
| ||
(1)硫酸和二氧化硫之间的关系式为2H2SO4----SO2,消耗0.2mol硫酸,n(SO2)=
| 1 |
| 2 |
| 1 |
| 2 |
答:生成气体在标况下体积为2.24L;
(2)生成二氧化硫需要n(Cu)=
| 1 |
| 2 |
| 1 |
| 2 |
根据3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O知,0.4mol氢离子完全反应需要硝酸根离子、铜的物质的量分别是0.1mol、0.15mol,所以铜和硝酸根离子都剩余,根据氢离子计算生成NO的物质的量,根据4H+----NO得生成n(NO)=
| 0.4mol |
| 4 |
答:生成NO的物质的量是0.1mol.
点评:本题考查了根据方程式的计算,根据方程式中各个物理量的关系式进行计算,易错点是(2)中要进行过量计算,根据不足量的物理量为标准进行计算,题目难度中等.

练习册系列答案
相关题目
下列反应中,属于吸热反应的是( )
| A、Na与H2O反应 |
| B、NaOH溶液与H2SO4溶液反应 |
| C、Al与Fe2O3反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A、标准状况下,33.6L CO2中含有氧原子数为3NA |
| B、1 mol OH-和1 mol-OH(羟基)所含质子数均为9NA |
| C、常温下,100mL 0.1mol?L-1醋酸钠溶液中含醋酸根的数目小于0.01NA |
| D、50mL 18.4mol?L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA |
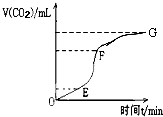 请用相关知识回答下列问题:
请用相关知识回答下列问题: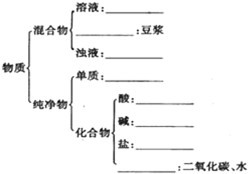 有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)
有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)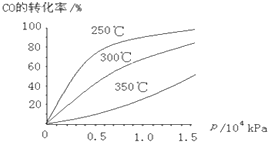 Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)
Ⅰ.一定温度下,将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:C02(g)+H2(g)?CO(g)+H2O(g)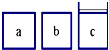 如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:
如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问: