题目内容
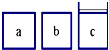 如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:
如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:①起始a、c两容器的反应速率大小关系为Va
②反应一段时间后a、c中速率大小关系为Va
③如起始在a、c两容器中通入同量的N2,则此时三容器起始压强为Pa
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:①起始时压强相等,则反应物的浓度相等,反应速率相等;
②c为恒压,c中压强大于a,结合压强对反应速率的影响判断;
③如起始在a、c两容器中通入同量的N2,N2不参加反应,c保持恒压,则体积应增大,结合浓度的影响判断反应速率.
②c为恒压,c中压强大于a,结合压强对反应速率的影响判断;
③如起始在a、c两容器中通入同量的N2,N2不参加反应,c保持恒压,则体积应增大,结合浓度的影响判断反应速率.
解答:
解:①起始时压强相等,则反应物的浓度相等,反应速率相等,故答案为:=;
②c为恒压,c中压强大于a,反应一段时间后a、c中速率大小关系为Va<Vc,故答案为:<;
③如起始在a、c两容器中通入同量的N2,N2不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa=Pb>Pc,反应速率Va=Vb,由于c体积最大,浓度最小,则反应速率最小,
故答案为:=;>;=;>.
②c为恒压,c中压强大于a,反应一段时间后a、c中速率大小关系为Va<Vc,故答案为:<;
③如起始在a、c两容器中通入同量的N2,N2不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa=Pb>Pc,反应速率Va=Vb,由于c体积最大,浓度最小,则反应速率最小,
故答案为:=;>;=;>.
点评:本题采用对比的方法考查了影响化学平衡移动的因素,根据压强对该反应的影响来分析解答,注意:改变压强是通过改变浓度来实现的,如果改变压强,而反应物和生成物浓度不变,则平衡不移动,为易错点.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、NH4Cl溶液与NaOH溶液混合:OH-+NH4+═NH3?H2O |
| B、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| C、将铝粉投入氢氧化钠溶液中:Al+2OH-═2AlO2- |
| D、NaHCO3溶液与盐酸混合:HCO3-+H+═CO32-+H2O |
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键.下列说法不正确的是( )
| A、沸点:W2R>W2Q |
| B、P与R形成化合物中,阴、阳离子个数比一定为1:2 |
| C、原子半径:W<R<Q<P |
| D、Q元素形成的酸一定是强酸 |
