题目内容
元素X原子的价电子排布为ns1,元素Y和Z的基态原子2p轨道上均有两个未成对电子,且原子序数为Y大于Z.则X、Y、Z三种元素组成的化合物的分子式不可能是( )
| A、X2ZY3 |
| B、X4Y2Z2 |
| C、X3YZ |
| D、X4ZY |
考点:原子核外电子排布,原子结构与元素的性质
专题:原子组成与结构专题
分析:X元素的原子最外层电子排布为ns1,为第ⅠA族元素,化合价为+1价,元素Y和Z的基态原子2p轨道上均有两个未成对电子,则其电子排布式为1S22S22P2或1S22S22P4,且原子序数为Y大于Z,所以Y元素是O元素,Z是C元素,结合C元素的成键特点判断.
解答:
解:X元素的原子最外层电子排布为ns1,为第ⅠA族元素,化合价为+1价,元素Y和Z的基态原子2p轨道上均有两个未成对电子,则其电子排布式为1S22S22P2或1S22S22P4,且原子序数为Y大于Z,所以Y元素是O元素,Z是C元素,C原子在有机物中形成4个共价键,
A.X2ZY3即X2CO3,为碳酸或碳酸盐,存在该化合物,故A不选;
B.X4Y2Z2即X4C2O2,为CH2(OH)-CHO,存在该化合物,故B不选;
C.X3YZY即X3CO,不满足碳的四价原理,不存在该化合物,故C选;
D.X4ZY即CH4O,存在该化合物,故D不选;
故选C.
A.X2ZY3即X2CO3,为碳酸或碳酸盐,存在该化合物,故A不选;
B.X4Y2Z2即X4C2O2,为CH2(OH)-CHO,存在该化合物,故B不选;
C.X3YZY即X3CO,不满足碳的四价原理,不存在该化合物,故C选;
D.X4ZY即CH4O,存在该化合物,故D不选;
故选C.
点评:本题考查元素推断题,考查角度为根据原子核外电子排布特点推断元素种类,并判断可能的化合物,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c (Mg2+)?c (CO32-)=6.82×10-6 |
| B、常温下,在0.10 mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,c( NH4+)/c(NH3?H2O)值变大 |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c (H2CO3) |
D、 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. |
下列有关实验操作或装置正确的是( )


| A、用图1所示装置进行乙酸乙酯水解 |
| B、用图2所示装置实验室制取乙烯 |
| C、碘水用CCl4萃取分液后再蒸馏,可得到I2 |
| D、梨形分液漏斗检漏,加水后玻璃旋塞处是否漏水即可 |
下列粒子中,电子排布式为1s22s22p63s23p6的有( )
| A、Sc3+ |
| B、Mg2+ |
| C、Cl- |
| D、Br- |
下列基态原子的电子排布式中,其未成对电子数最多的是( )
| A、1s22s22p63s23p63d54s1 |
| B、1s22s22p63s23p3 |
| C、1s22s22p63s23p63d64s2 |
| D、1s22s22p63s23p63d74s2 |
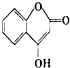 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: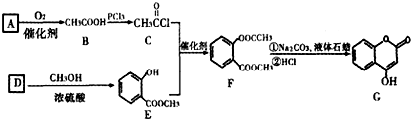
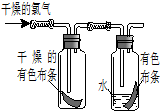 (1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是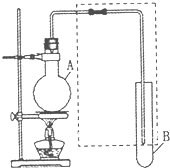 如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请