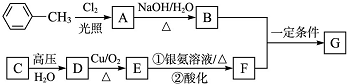
题目内容
下列说法正确的是( )
| A、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c (Mg2+)?c (CO32-)=6.82×10-6 |
| B、常温下,在0.10 mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,c( NH4+)/c(NH3?H2O)值变大 |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c (H2CO3) |
D、 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. |
考点:难溶电解质的溶解平衡及沉淀转化的本质,盐类水解的应用
专题:基本概念与基本理论
分析:A、含有固体MgCO3的溶液中c(Mg2+)和c(CO32-)不一定相等;
B、NH3?H2O溶液中加入少量NH4Cl晶体,增大了c(NH4+),抑制了NH3?H2O的电离,c(NH3?H2O)减小;
C、pH=8.3,溶液呈碱性,说明水解大于电离;
D、强酸滴定强碱时,接近滴定终点时pH 发生突变.
B、NH3?H2O溶液中加入少量NH4Cl晶体,增大了c(NH4+),抑制了NH3?H2O的电离,c(NH3?H2O)减小;
C、pH=8.3,溶液呈碱性,说明水解大于电离;
D、强酸滴定强碱时,接近滴定终点时pH 发生突变.
解答:
解:A、Ksp与温度有关,Ksp=c(Mg2+)?c(CO32-)=6.82×10-6成立,当含有其他镁离子或碳酸根离子的混合溶液中,不一定存在碳酸根离子浓度和镁离子浓度相同,故A错误;
B、NH3?H2O溶液中加入少量NH4Cl晶体,增大了c(NH4+),抑制了NH3?H2O的电离,c(NH3?H2O)减小,因此二者比值变大,故B正确;
C、pH=8.3,溶液呈碱性,说明水解大于电离,水解生成H2CO3而电离产生CO32-,钠离子不水解,HCO3-存在两种趋势,但两种趋势都极其微弱,故离子浓度大小顺序为c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D、强酸滴定强碱时,接近滴定终点时pH 发生突变,图示中当PH等于7左右,没有出现突变,故D错误;
故选B.
B、NH3?H2O溶液中加入少量NH4Cl晶体,增大了c(NH4+),抑制了NH3?H2O的电离,c(NH3?H2O)减小,因此二者比值变大,故B正确;
C、pH=8.3,溶液呈碱性,说明水解大于电离,水解生成H2CO3而电离产生CO32-,钠离子不水解,HCO3-存在两种趋势,但两种趋势都极其微弱,故离子浓度大小顺序为c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D、强酸滴定强碱时,接近滴定终点时pH 发生突变,图示中当PH等于7左右,没有出现突变,故D错误;
故选B.
点评:本题综合性较强,设计难容电解质的溶解平衡、弱电解质的电离平衡、盐类水解平衡、酸碱中和滴定,难度较大,水溶液中的化学平衡是高考的热点、难点,注意培养化学反应原理的应用能力.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、24g NaH中阴离子所含电子总数为NA |
| B、1mol苯分子中含有3NA个碳碳单键 |
| C、NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D、在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是( )
| A、单质都是由同种元素组成的,只含一种元素的物质一定是纯净物 |
| B、金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气 |
| C、中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 |
| D、氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
元素X原子的价电子排布为ns1,元素Y和Z的基态原子2p轨道上均有两个未成对电子,且原子序数为Y大于Z.则X、Y、Z三种元素组成的化合物的分子式不可能是( )
| A、X2ZY3 |
| B、X4Y2Z2 |
| C、X3YZ |
| D、X4ZY |

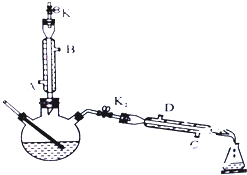 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题