题目内容
下列说法正确的是( )
| A、4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | ||||||||||
| B、一定温度下,氯化铵水解离子方程式:NH+4+H2O?NH3?H2O+H+,若用KW表示的离子积,Kb表示氨水电离常数,则氯化铵水解平衡常数K=KW/Kb | ||||||||||
| C、已知反应:2Fe3++2I-=2Fe2++I2:2Co(OH)3+2Cl-+6H+=2Co2++Cl2↑+6H2O:2Fe(OH)2+I2+2OH-=2Fe(OH)3+2I-;则在酸性溶液中氧化性:Fe3+>Co(OH)3>I2 | ||||||||||
D、已知
|
考点:物质结构中的化学键数目计算,氧化性、还原性强弱的比较,反应热和焓变,化学平衡的影响因素
专题:
分析:A、不知道C2H6O结构,无法判断46gC2H6O中含有的C-H极性键数目;
B、根据NH3?H2O的电离方程式及水的电离和NH+4+H2O?NH3?H2O+H+的关系,可求NH3?H2O的电离平衡常数;
C、在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,由此分析;
D、反应热等于反应的总键能减去生成物的总键能,1mol硅晶体中含有2mol的Si-Si,△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol.
B、根据NH3?H2O的电离方程式及水的电离和NH+4+H2O?NH3?H2O+H+的关系,可求NH3?H2O的电离平衡常数;
C、在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,由此分析;
D、反应热等于反应的总键能减去生成物的总键能,1mol硅晶体中含有2mol的Si-Si,△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol.
解答:
解:A、46g分子式为C2H6O的物质的量为1mol,若C2H6O为甲醚,1mol中含有6mol碳氢极性键,若是乙醇,含有5molC-H键,故A错误;
B、根据NH3?H2O的电离方程式及水的电离和NH+4+H2O?NH3?H2O+H+,K=
,的分子和分母同乘以氢氧根离子的浓度,得K=KW/Kb,故B正确;
C、由反应2Fe3++2I-=2Fe2++I2,可知氧化性Fe3+>I2,2Co(OH)3+2Cl-+6H+=2Co2++Cl2↑+6H2O,可知氧化性Co(OH)3>Cl2,2Fe(OH)2+I2+2OH-=2Fe(OH)3+2I-,可知氧化性I2>Fe(OH)3,综合得到Co(OH)3>I2>Fe(OH)3,故C错误;
D、反应热等于反应的总键能减去生成物的总键能,1mol硅晶体中含有2mol的Si-Si,△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,故D错误
故选B.
B、根据NH3?H2O的电离方程式及水的电离和NH+4+H2O?NH3?H2O+H+,K=
| c(H+)×c(NH3?H2O) | ||
c(N
|
C、由反应2Fe3++2I-=2Fe2++I2,可知氧化性Fe3+>I2,2Co(OH)3+2Cl-+6H+=2Co2++Cl2↑+6H2O,可知氧化性Co(OH)3>Cl2,2Fe(OH)2+I2+2OH-=2Fe(OH)3+2I-,可知氧化性I2>Fe(OH)3,综合得到Co(OH)3>I2>Fe(OH)3,故C错误;
D、反应热等于反应的总键能减去生成物的总键能,1mol硅晶体中含有2mol的Si-Si,△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,故D错误
故选B.
点评:本题考查了反应热的计算,注意反应热中硅的键能,在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,每个Si-Si键被两个Si原子共用,所以每个硅原子含有2个共价键,此点为易错点.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A、0.5molCl2与铁反应转移电子数为NA |
| B、在标准状况下,NA个任何分子所占的体积均约为22.4L |
| C、300mL 5mol/L KNO3溶液与300mL 5mol/L KCl溶液含有的离子数均约为3NA |
| D、16gO2和O3中所含的氧原子数均为NA |
下列说法正确的是( )
A、相同条件下,结合质子的能力:OH->AlO2->CO32->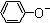 >HCO3->CH3COO- >HCO3->CH3COO- |
B、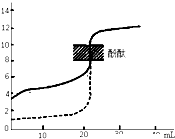 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
下列反应的离子方程式书写正确的是( )
| A、用醋酸溶液除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向FeBr2溶液中通入足量Cl2:Fe3++2Br-+Cl2═Fe3++Br2+2Cl- |
| C、向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3- |
| D、向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |



 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题:
 ,写出此有机物分子中含有的官能团名称:
,写出此有机物分子中含有的官能团名称: 结构且能水解的所有同分异构体的结构简式:
结构且能水解的所有同分异构体的结构简式: