题目内容
3.将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量浓度为0.4mol/L,则:(1)用反应物B的浓度改变来表示该反应的速率为:0.02 mol•L-1•s-1;
(2)反应前A的物质的量浓度是:1.5mol•L-1;
(3)t 秒(s)末,混合气体的密度不变不能(能或不能)说明反应达到平衡.
分析 反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量浓度为0.4mol/L,可知生成C为0.4mol×2L=0.8mol,则
3A(g)+B(g)?2C(g)+D(g),
10s 1.8 0.6 0.8 0.4
转化 1.2 0.4 0.8 0.4
开始 3 1 0.8 0.4
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$及混合气体的密度始终不变来解答.
解答 解:反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量浓度为0.4mol/L,可知生成C为0.4mol×2L=0.8mol,则
3A(g)+B(g)?2C(g)+D(g),
10s 1.8 0.6 0.8 0.4
转化 1.2 0.4 0.8 0.4
开始 3 1 0.8 0.4
(1)用反应物B的浓度改变来表示该反应的速率为$\frac{\frac{0.4mol}{2L}}{10s}$=0.02 mol•L-1•s-1,故答案为:0.02 mol•L-1•s-1;
(2)反应前A的物质的量浓度是$\frac{3mol}{2L}$=1.5mol•L-1,故答案为:1.5mol•L-1;
(3)由ρ=$\frac{m}{V}$可知,气体的质量、体积不变,则密度始终不变,秒(s)末,混合气体的密度不变时不能说明反应达到平衡,故答案为:不能.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡状态的判定为解答的关键,侧重分析与应用能力的考查,注意利用反应计算转化的量,题目难度不大.

| A. | 4.6g 由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA | |
| B. | 0.2 g D216O中含有的质子数,中子数,电子数均为0.1NA | |
| C. | 铁与足量稀硝酸反应时,生产0.1mol NO转移的电子数为0.3NA | |
| D. | 6.2克白磷分子(P4)中含P-P键为0.05NA |
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.45mol/L | D. | 0.2mol/L |
| A. | 容量瓶事先没有烘干 | B. | 定容时观察液面俯视 | ||
| C. | 定容时观察液面仰视 | D. | 定容后,摇匀时有少量液体流出 |
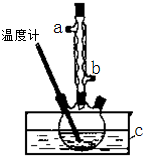 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):