题目内容
用化学方程式表示硫酸型酸雨的形成过(2个途径)
途径一: , .
途径二: , .
途径一:
途径二:
考点:二氧化硫的污染及治理
专题:元素及其化合物
分析:途经一:当雨水的pH<5.6时称为酸雨,硫酸型“酸雨”的形成过程可近似地看成是:排放到空气中的二氧化硫与潮湿空气中的氧气和水蒸气,在空气中粉尘的催化下化合生成硫酸;
途径二:是空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨
途径二:是空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨
解答:
解:途径一:空气中的SO2可与雨水反应,发生SO2+H2O?H2SO3,H2SO3进一步被氧气氧化生成H2SO4,其反应方程式为:2H2SO3+O2=2H2SO4,硫酸溶在雨水中,使雨水呈酸性,形成酸雨;
故答案为:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4;
途径二:空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,故化学方程式为:2SO2+O2
2SO3;SO3+H2O=H2SO4;
故答案为:2SO2+O2
2SO3;SO3+H2O=H2SO4.
故答案为:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4;
途径二:空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,故化学方程式为:2SO2+O2
| ||
故答案为:2SO2+O2
| ||
点评:本题考查了酸雨形成的过程分析,正确找出反应物、生成物、反应条件,正确书写化学方程式;掌握酸的化学性质,题目较简单.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列装置或操作能达到实验目的是( )
A、 量取8.5mL稀硫酸 |
B、 制备FeNaOH溶液 |
C、 防止铁钉生锈 |
D、 用酒精萃取水中的溴 |
在硫酸、明矾和硫酸钾组成的混合溶液中,c(Al3+)=0.4mol?L-1、c(SO42-)=0.8mol?L-1、水电离的
c(H+)=10-13 mol?L-1、则c(K+)为( )
c(H+)=10-13 mol?L-1、则c(K+)为( )
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
化学实验中的安全意识是重要的科学素养.下列对实验中出现的事故处理方法正确的是( )
| A、皮肤上沾上浓硫酸应立即用氢氧化钠溶液中和 |
| B、酒精灯中酒精不慎洒出在桌上燃烧,应立即用湿布扑盖 |
| C、氢氧化钠溶液溅到眼睛中,立即闭上眼睛,轻轻揉搓 |
| D、实验中出现轻微气体中毒,受伤人员应立即伏到实验桌上好好休息 |



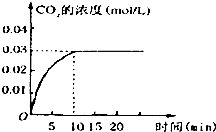 在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图:
在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图: 下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:
下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空: