题目内容
14.关于下列各装置图的叙述中,正确的是( )
| A. | 用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的正极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
分析 A、根据电流的方向判断电源的正负极,精炼铜时粗铜做阳极;
B、铁比铜活泼,为原电池的负极;
C、装置③为外加电源的阴极保护法,钢闸门应与外接电源的负极相连;
D、浓硫酸具有吸水性,在干燥的环境中铁难以腐蚀.
解答 解:A、根据电流的方向可知a为电解池的阳极,则用来精炼铜时,a极为粗铜,电解质溶液为CuSO4溶液,故A错误;
B、铁比铜活泼,为原电池的负极,发生的反应为Fe+2Fe3+=3Fe2+,故B错误;
C、装置③为外加电源的阴极保护法,钢闸门与外接电源的负极相连,电源提供电子而防止铁被氧化,故C错误;
D、浓硫酸具有吸水性,在干燥的环境中铁难以腐蚀,故D正确.
故选D.
点评 本题考查原电池和电解池的工作原理,题目难度不大,本题易错点为D,注意浓硫酸的性质对金属腐蚀的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列有关化学用语表示正确的是( )
| A. | CO2分子的比例模型: | |
| B. | 过氧化氢的电子式: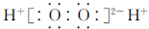 | |
| C. | 氟原子的结构示意图: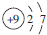 | |
| D. | H2CO3的电离方程式:H2CO3?2H++CO32- |
5.用图示装置电解饱和食盐水,当生成气体体积为4.48L(标况)时,下列说法正确的是( )
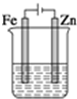

| A. | 溶液中氯离子向锌电极移动 | B. | 锌电极上生成氧化产物 | ||
| C. | 两端电极产生相等体积的气体 | D. | 电路中电子转移数为0.4NA |
2.现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复).
已知:①0.1mol/L A溶液中c(H+)>0.1mol/L;
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶
解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0.1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶
解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0.1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
3.化学与社会、技术、环境、生活密切相关.下列说法正确的是( )
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 空气中直径小于或等于2.5?m的颗粒物称为PM2.5 | |
| C. | pH<7的雨水称为酸雨,对环境造成很大的危害 | |
| D. | 甲醛的水溶液可以作为鱿鱼等海鲜的防腐剂 |
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为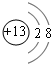 .
.

 .
.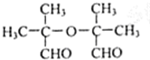 .
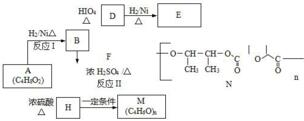
.
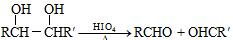
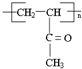 .
.