题目内容
下列离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、硅酸钠溶液与醋酸溶液反应:SiO32-+2H+=H2SiO3↓ |
| C、硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| D、浓硝酸中加入烧碱溶液:OH-+H+=H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.电荷不守恒;
B.乙酸为弱酸,在离子方程式中应保留化学式;
C.一水合氨是弱电解质,在离子方程式中应保留化学式;
D.浓硝酸中加入烧碱溶液生成硝酸钠和水.
B.乙酸为弱酸,在离子方程式中应保留化学式;
C.一水合氨是弱电解质,在离子方程式中应保留化学式;
D.浓硝酸中加入烧碱溶液生成硝酸钠和水.
解答:
解:A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.乙酸为弱酸,在离子方程式中应保留化学式,所以硅酸钠溶液与醋酸溶液反应为:2CH3COOH+SiO32-=H2SiO3↓+2CH3COO-,故B错误;
C.一水合氨是弱电解质,在离子方程式中应保留化学式,所以硫酸铝溶液中加入过量氨水:3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.浓硝酸中加入烧碱溶液生成硝酸钠和水,其反应的离子方程式为:OH-+H+=H2O,故D正确.
故选D.
B.乙酸为弱酸,在离子方程式中应保留化学式,所以硅酸钠溶液与醋酸溶液反应为:2CH3COOH+SiO32-=H2SiO3↓+2CH3COO-,故B错误;
C.一水合氨是弱电解质,在离子方程式中应保留化学式,所以硫酸铝溶液中加入过量氨水:3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.浓硝酸中加入烧碱溶液生成硝酸钠和水,其反应的离子方程式为:OH-+H+=H2O,故D正确.
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应及离子反应中应保留化学式的物质即可解答,题目难度不大.

练习册系列答案
相关题目
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4C1溶液、盐酸和Na2SO4溶液中的一种.已知A、B溶液中水的电离程度相同,A、C溶液的pH相同.下列说法中不正确的是( )
| A、D溶液的PH=7 |
| B、四种溶液相比,C溶液中水的电离程度最大 |
| C、A与C等体积混合,溶液中有c(C1-)>c(NH4+)>c(H+)>c(OH-) |
| D、B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+) |
下列化学式表示的一定是纯净物的是( )
| A、C3H8 |
| B、C12H22011 |
| C、C2H402 |
D、 |
下列离子方程式正确的是( )
| A、氢氧化镁中滴加盐酸:2H++Mg(OH)2═Mg2++2H2O | ||
| B、金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | ||
C、在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO
| ||
| D、用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
下列电离或离子方程式正确的是( )
| A、亚硫酸的电离:H2SO3?2H++SO32- |
| B、氯化铵水解的离子方程式为:NH4++H2O?NH3?H2O+H+ |
| C、NaHCO3水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
| D、向氯化铝溶液中加入过量的氨水:A13++3NH3?H2O=Al(OH)3↓+3NH4+ |
下列叙述中,正确的是( )
| A、金属与酸反应一定放出氢气 |
| B、含金属元素的离子一定是阳离子 |
| C、电离生成H+的化合物不一定是酸 |
| D、金属离子被还原一定得到金属单质 |
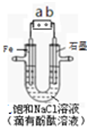 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、1mol NH3含有的电子数10NA |
| C、常温常压下,22.4L的氧气含氧原子数为2NA |
| D、常温下,1L 0.1mol?L-1 AlCl3溶液中含Al3+数为0.1NA |
