题目内容
20.某实验中得到A、B、C三种液体的混合物,其信息如表:| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| A | 78 | 0.8786 | 80 | A,B,C互溶 |
| B | 74 | 0.81018 | 108 | |
| C | 130 | 0.8670 | 142 |
| A. | 不能用蒸馏的方法进行分离 | |
| B. | 可以用过滤的方法进行分离 | |
| C. | 若采用蒸馏操作,冷凝管中冷却水的流向应该与蒸气的流向相反 | |
| D. | 该实验中用到的玻璃仪器有:酒精灯、蒸溜烧瓶、冷凝管、接液管、锥形瓶 |
分析 A,B,C互溶,且沸点相差较大,可用蒸馏的方法分离,以此解答该题.
解答 解:由表中数据可知A,B,C互溶,且沸点相差较大,可用蒸馏的方法分离,蒸馏时,冷凝管中冷却水的流向应该与蒸气的流向相反,蒸馏时,除酒精灯、蒸溜烧瓶、冷凝管、接液管、锥形瓶之外,还需要温度计,只有C正确.
故选C.
点评 本题考查物质的分离、提纯,为高频考点,侧重考查学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大,注意把握物质的性质以及操作方法.

练习册系列答案
相关题目
8.获得“863”计划和中科院一百人计划支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e═Al3+ | |
| B. | 电池工作时,溶液中的铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 正极的电极材料是单质碘 |
5.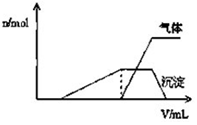 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ Mg2+ |
| 可能大量含有的阴离子 | Cl-Br-I?AlO2- CO32- |
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | a mol | 0 | 0 |
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
12.实验室中电解饱和食盐水溶液时,不能直接得到的物质是( )
| A. | 氯化氢 | B. | 氢气 | C. | 氢氧化钠 | D. | 氯气 |
9.常温下,用0.10mol/LNaOH溶液滴定20.00mL稀醋酸(HAc),下列说法中正确的是( )
| A. | 当混合溶液的pH>7时,其中不可能存在HAc分子 | |
| B. | 当混合溶液的pH<7时,混合液中c(Na+)>c((Ac-) | |
| C. | 判断该滴定过程的终点,最好选择甲基橙作为指示剂 | |
| D. | 达到滴定终点时,混合液中c(Na+)和c((Ac-)一定不相等 |
10.下列生活、生产的运用中涉及了氧化还原反应的是( )
| A. | 用Al(OH)3治疗胃酸过多 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用金属铝进行铝热法炼铁 | D. | 用水玻璃制备硅胶和木材防火剂 |
 名称:2,3-二甲基辛烷
名称:2,3-二甲基辛烷 名称:3,5-二甲基庚烷.
名称:3,5-二甲基庚烷. 在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)
在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体) 有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.
有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用. (任写一种).
(任写一种).