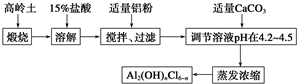
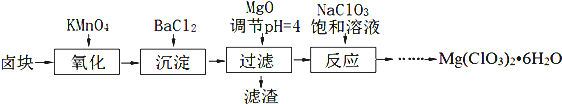
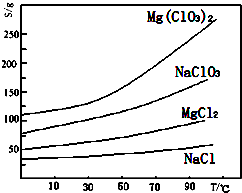
题目内容
2.生物学家研究发现白蚁信息素有: (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )| A. | 以上三种信息素互为同系物 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同分异构体 | |
| D. | 家蚕的性信息素与1molBr2加成产物只有一种 |
分析 A.同系物必须具有相似结构,CH3(CH2)8CH=CH-CH=CH(CH2)8CH3中含有两个碳碳双键,2,4-二甲基-1-庚烯和3,7-二甲基-1-辛烯分子中均只含1个碳碳双键;
B.以上三种信息素中都含有官能团碳碳双键,都能够与溴水发生加成反应;
C.同分异构体必须具有相同分子式,2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯中含有的碳原子数不同;
D.家蚕信息素与溴可发生1,2加成或1,4加成.
解答 解:A.CH3(CH2)2CH=CH-CH=CH(CH2)8CH3分子中含有2个碳碳双键,而2,4-二甲基-1-庚烯和3,7-二甲基-1-辛烯分子中均只含1个碳碳双键,它们的结构不同,所以它们不属于同系物,故A错误;
B.三种信息素均含碳碳双键,均能与溴的四氯化碳溶液中的溴发生加成反应使之褪色,故B正确;
C.2,4-二甲基-1-庚烯中含有9个C,而3,7-二甲基-1-辛烯中含有10个C,二者的分子式不同,则一定不属于同分异构体,故C错误;
D.家蚕信息素CH3(CH2)2CH=CH-CH=CH(CH2)8CH3与溴发生加成反应时,可分别加在两个双键上,产物不只一种,故D错误;
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,题目难度中等,注意把握有机物的官能团的性质,明确同系物、同分异构体等概念的含义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.有两瓶失去标签的Na2CO3溶液和NaHCO3溶液,它们的物质的量浓度相同,下列试剂可用于区别这两种溶液的是( )
| A. | NaCl溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | 澄清石灰水 |
10.下列叙述正确的是( )
| A. | 浓硝酸、浓硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
17.下列叙述中,不能用勒夏特列原理解释的是( )
| A. | 合成氨需用铁触媒加快反应速率 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 收集氯气可用排饱和食盐水法 |
19.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
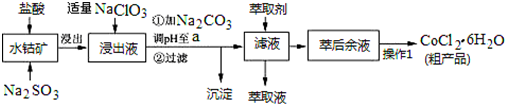
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..
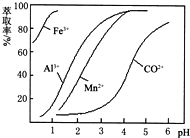
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.
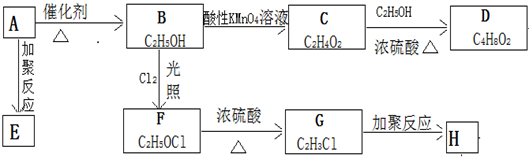
 ; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.