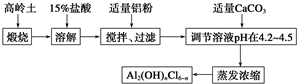
题目内容
4.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )| A. | Al3+、ClO-、Cl- | B. | Na+、NH4+、Cl- | C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
分析 溶液中存在较多的H+、SO42-、NO3-,离子之间不能结合生成沉淀、气体、水,不能发生氧化还原反应等,则离子大量共存.
解答 解:A.H+、ClO-结合生成次氯酸,次氯酸为弱酸,不能大量共存,故A不选;
B.该组离子之间不反应,可大量共存,故B选;
C.Fe2+与H+和NO3-发生氧化还原反应,故不能大量共存,故C不选;
D.Ba2+、SO42-结合生成沉淀,不能大量共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
15.下列叙述正确的是( )
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
12.有两瓶失去标签的Na2CO3溶液和NaHCO3溶液,它们的物质的量浓度相同,下列试剂可用于区别这两种溶液的是( )
| A. | NaCl溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | 澄清石灰水 |
19.下列说法错误的是( )
| A. | SiO2是沙子的主要成分,纯净的SiO2是光纤制品的基本原料 | |
| B. | 水晶的基本结构单元是[SiO4]四面体结构 | |
| C. | 将游离态的氮转变为氮的化合物就是氮的固定,合成氨是一种人工固氮方法 | |
| D. | 将等物质的量的氯气和二氧化硫同时通入品红溶液中,褪色比二氧化硫通入品红溶液快 |
9.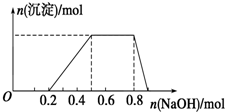 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )| A. | 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42- | |
| B. | 肯定不含的阳离子是Mg2+、Fe3+ | |
| C. | 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色 | |
| D. | 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42-)=2:3:1:4 |
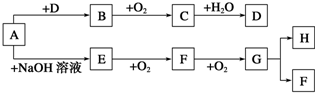
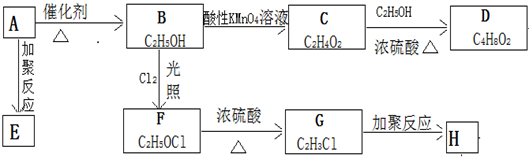
 ; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.