题目内容
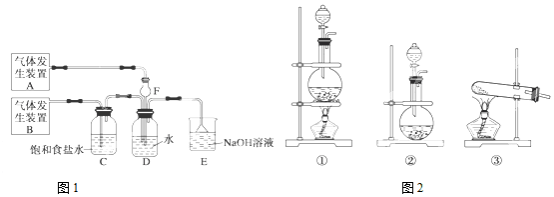
8.为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按图步骤操作
(1)写出三种试剂的化学式:ABa(OH)2 BK2CO3 CHCl
(2)加过量A的目的是:为了除尽Mg2+和SO42-有关反应的化学方程式为:MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓、MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
(3)加过量B的目的是:为了除尽过量的Ba2+
(4)若先加过量C后再过滤,将对实验结果产生影响,其原因是在此酸性条件下,会有部分沉淀溶解,从而影响制得的KCl溶液的纯度.
分析 除去KCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此A选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2可加入B,即所选试剂中的K2CO3而除去;最后通过滴加C盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,以此解答该题.
解答 解:(1)由以上分析可知A为Ba(OH)2,B为K2CO3,C为HCl,故答案为:Ba(OH)2;K2CO3;HCl;
(2)为确保混合溶液中的MgCl2和MgSO4全部反应而沉淀掉,故应加入过量的Ba(OH)2,生成Mg(OH)2、BaSO4,反应的化学方程式为MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓,
故答案为:为了除尽Mg2+和SO42-;MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓; MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓;
(3)加过量B发生K2CO3+Ba(OH)2=BaCO3↓+2KOH,目的是除去过量的Ba2+,
故答案为:为了除尽过量的Ba2+;
(4)若先加过量C后再过滤,在此酸性条件下,会有部分沉淀溶解,从而影响制得的KCl溶液的纯度,
故答案为:在此酸性条件下,会有部分沉淀溶解,从而影响制得的KCl溶液的纯度.
点评 本题考查物质的分离、提纯综合应用及实验,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握流程中的反应及混合物分离方法,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
18.下列实验操作正确的是( )
| A. | 用水不能区别酒精、苯和四氯化碳 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 在用水吸收HCl气体时可把导管直接插入液面下 |
19.下列说法不正确的是( )
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
13.下列离子方程式的书写,正确的是( )
| A. | 足量的烧碱溶液与二氧化碳的反应:OH-+CO2═HCO3- | |
| B. | 盐酸溶液与硝酸银溶液反应:HCl+Ag+═AgCl↓+H+ | |
| C. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
20.乙烯催化氧化成乙醛可设计成如图所示的电化学装置,下列有关说法正确的是( )
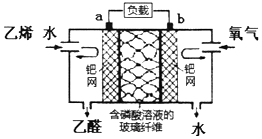

| A. | 该电化学装置是电解池 | |
| B. | a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 氧气在b极被氧化 | |
| D. | 电子移动方向:电极a→负载→电极b→磷酸溶液→电极a |

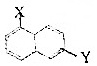 和
和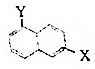
 请填写下列空白:
请填写下列空白: