题目内容
8.(1)现有34g某气体,摩尔质量为17 g•mol-1.则:①该气体物质的量为2mol.
②该气体所含分子数为2NA
③该气体在标准状况下的体积为44.8L
(2)36g H2O中的氧原子数目与标准状况下22.4LCO2中的氧原子数目相同.
分析 (1)依据n=$\frac{m}{M}$=$\frac{V}{Vm}$=$\frac{N}{N{{\;}_{A}}_{\;}}$计算解答.
(2)根据n=$\frac{V}{Vm}$计算二氧化碳的物质的量,结合O原子数目相等计算水的物质的量,再根据m=nM计算水的总质量.
解答 解:(1)①依据n=$\frac{m}{M}$=$\frac{34g}{17g/mol}$=2mol;
故答案为:2;
②该气体所含分子数=n×NA=2mol×NA=2NA,
故答案为:2;
③该气体在标准状况下的体积=n×22.4L/mol=2mol×22.4L/mol=44.8L;
故答案为44.8;
(2)标准状况下22.4LCO2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,与之含有氧原子数目相同的水的质量为$\frac{1mol×2}{1}$×18g/mol=36g;
故答案为:36.
点评 本题考查物质的量有关计算,比较基础,注意对化学式意义的理解,熟悉以物质的量为核心的计算公式是解题关键,有利于基础知识的巩固.

练习册系列答案
相关题目
16.实验室在配制硫酸亚铁溶液时,先把硫酸亚铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是( )
| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
3.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
13.下列说法正确的是( )
| A. | 电子从3s能级跃迁到3p能级形成的光谱是发射光谱 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为109°28′ | |
| C. | NO2- 中心原子采取sp2杂化,分子空间构型为“V”形 | |
| D. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
20.铝可以制成多种建筑型材,铝在空气中能够稳定存在的原因是( )
| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
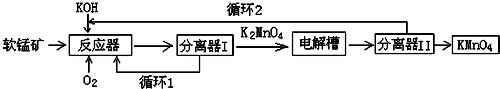
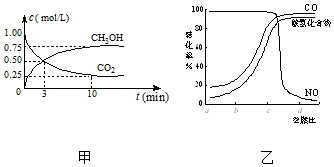 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.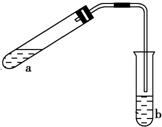 可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: