题目内容
10.下列变化过程中,△S<0的是( )| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
分析 △S<0,说明反应或变化过程中混乱度减小,依据微粒数变化或反应前后气体体积变化分析判断.
解答 解:A、氯化钠溶于水中,固体变成溶液,混乱度增大,△S>0,故A错误;
B、NH3(g)与HCl(g)反应生成NH4Cl(s),气体体积减小,反应后熵变减小,△S<0,故B正确;
C、干冰(CO2)的升华,混乱度增大,△S>0,故C错误;
D、CaCO3(s)分解为CaO(s)和CO2(g),气体体积增大,混乱度增大,△S>0,故D错误;
故选B.
点评 本题考查了熵变的判断,反应过程或变化过程中微粒的变化多少,气体体积的变化是判断依据,题目较简单.

练习册系列答案
相关题目
18. 某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )
某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )
 某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )
某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )| A. | 10 | B. | 11 | C. | 13 | D. | 12 |
5.下列说法中正确的是( )
| A. | 1mol某气体的体积为22.4L,该气体所处的状态一定是标准状况 | |
| B. | 将22.4L氯化氢气体溶解于水并配成1L溶液,所得溶液浓度为1mol•L-1 | |
| C. | 任何状况下,1molCO2和18gH2O所含的分子数和原子数都相等 | |
| D. | 20ml0.1mol/L的AlCl3溶液中的Cl-的物质的量浓度小于50mL0.2mol/L的NaCl溶液中的Cl-的物质的量浓度 |
15.现有常温下的四份溶液:①0.01mol/L CH3COOH;②0.01mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A. | 将①、④等体积混合,混合液一定呈碱性 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②=③ | |
| C. | 水的电离程度:①<② | |
| D. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
2.下列物质中的主要成分不属于糖类的是( )
| A. | 棉花 | B. | 纤维素 | C. | 豆油 | D. | 淀粉 |
19.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 44g CO2含有氧原子数为NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 23gNa在足量的O2中充分燃烧失去2mole-生成Na2O2 | |
| D. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
 .
.
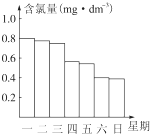 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.