题目内容
18. 某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )
某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )| A. | 10 | B. | 11 | C. | 13 | D. | 12 |
分析 离子积常数=c(H+)•c(OH-),据此计算出该温度下水的离子积,根据离子积常数计算0.01mol•L-1的NaOH溶液中氢离子浓度,最后根据pH=-lgc(H+)计算该氢氧化钠溶液的pH.
解答 解:根据图象可知,当c(H+)=10-5 mol/L时c(OH-)=10-10 mol/L,则该温度下离子积常数=c(H+).c(OH-)=10-5.10-10=10-15;
则该温度下0.01mol•L-1的NaOH溶液中氢离子浓度=$\frac{1{0}^{-15}}{0.01}$mol/L=10-13mol/L,该溶液的pH=-lgc(H+)=13,
故选C.
点评 本题考查了溶液pH的有关计算,题目难度中等,注意水的离子积常数=c(H+)•c(OH-)的应用,为易错点,明确溶液pH的表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
8.(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol.又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是1016.5kJ.
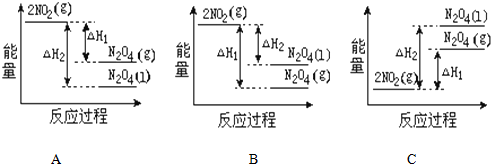
(2)已知:2NO2(g)═N2O4(g)△H1 2NO2(g)═N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)A.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH). 已知某些化学键的键能数据如表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
(2)已知:2NO2(g)═N2O4(g)△H1 2NO2(g)═N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)A.

(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH). 已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
9.下列有关实验的说法不正确的是( )
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
6.Ⅰ.肼是一种高能燃料.已经各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如下:
则N2H4(g)+O2(g)?N2(g)+2H2O(l)△H=-583 KJ•mol-1
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序B>C>A(用A、B、C表示).
Ⅲ.25℃时,Fe(OH)3的ksp=4ⅹ10-38,现有盐酸酸化的0.08mol/L的FeCl3溶液,其PH=1,向其中加入等体积的0.05mol/L的NaOH溶液,可恰好开始析出沉淀(混合时溶液体积可直接加和).
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
13.下列方程式书写正确的是( )
| A. | NaHCO3溶液的电离:NaHCO3═Na++HCO3- | |
| B. | 氯化铵溶液的水解:NH4++H2O═NH3•H2O+H+ | |
| C. | 碳酸钠的水解:CO32-+2H2O═H2CO3+2OH- | |
| D. | 氯化铝和碳酸钠溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2 |
10.下列变化过程中,△S<0的是( )
| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
7.下表是元素周期表的一部分,请用化学用语回答:
(1)在这些元素中,最活泼的非金属元素是F,原子最外层达到稳定结构的元素是Ar;
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为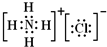 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为
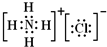 .
.
8.标准状况下,22.4LCO2的物质的量为( )
| A. | 0.20mol | B. | 0.50mol | C. | 1.0mol | D. | 2.0mol |