题目内容
15.现有常温下的四份溶液:①0.01mol/L CH3COOH;②0.01mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )| A. | 将①、④等体积混合,混合液一定呈碱性 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②=③ | |
| C. | 水的电离程度:①<② | |
| D. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
分析 四份溶液中溶质都是抑制水的电离的,①中CH3COOH电离出的H+浓度最小,②③④中电离出的H+、OH-浓度都为0.01 mol•L-1,其中醋酸和一水合氨为弱电解质,加水促进电离,结合浓度对弱电解质的电离的影响解答该题.
解答 解:A.若将①、④等体积混合,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,故A正确;
B.一水合氨为弱电解质,②③若等体积混合后溶液呈碱性,若有pH=7,则消耗溶液的体积:②>③,故B错误;
C.四份溶液中溶质都是抑制水的电离的,其中②③④中H+、OH-浓度相等,对水的电离的抑制也相等,且大,①中CH3COOH电离出的H+浓度最小,因此其中水的电离程度最小,水的电离程度:①>②,故C错误;
D.将四份溶液稀释相同倍数后溶液的pH:氨水存在电离平衡,溶液中氢氧根离子浓度大于氢氧化钠溶液中氢氧根离子,③>④,同浓度醋酸和盐酸稀释相同倍数,醋酸存在电离平衡,不能完全电离,醋酸溶液中氢离子浓度小于盐酸溶液中的氢离子浓度,所以溶液PH①>②,故D错误;
故选A.
点评 本题考查较为综合,涉及弱电解质的电离平衡应用,为高考常见题型,侧重于水的电离影响,溶液酸碱性的判断,溶液稀释的PH变化,关键是酸碱反应后溶液酸碱性的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 碱性氧化物一定是金属氧化物 |
6.Ⅰ.肼是一种高能燃料.已经各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如下:
则N2H4(g)+O2(g)?N2(g)+2H2O(l)△H=-583 KJ•mol-1
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序B>C>A(用A、B、C表示).
Ⅲ.25℃时,Fe(OH)3的ksp=4ⅹ10-38,现有盐酸酸化的0.08mol/L的FeCl3溶液,其PH=1,向其中加入等体积的0.05mol/L的NaOH溶液,可恰好开始析出沉淀(混合时溶液体积可直接加和).
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
10.下列变化过程中,△S<0的是( )
| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
7.下表是元素周期表的一部分,请用化学用语回答:
(1)在这些元素中,最活泼的非金属元素是F,原子最外层达到稳定结构的元素是Ar;
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为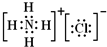 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为
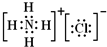 .
.
4.下列现象因发生物理变化引起的是( )
| A. | 活性炭使蓝色墨水褪色 | |
| B. | 盛石灰水的试剂瓶久置后内壁出现白色固体 | |
| C. | 蛋白质灼烧时发出烧焦羽毛的气味 | |
| D. | 湿润红布条置于氯气的集气瓶中,红布条褪色 |
5. 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )| A. | 该有机物与溴水发生加成反应 | |
| B. | 该有机物与浓硫酸混合加热可发生消去反应 | |
| C. | 该有机物经催化氧化后能发生银镜反应 | |
| D. | 1mol该有机物与足量NaOH溶液反应最多消耗3molNaOH |