题目内容
13.印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过如图流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.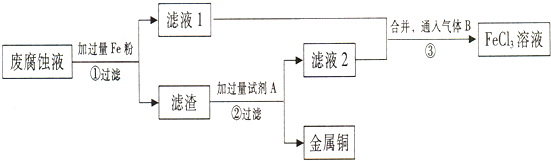
步骤①中发生反应的离子方程式2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu.
(2)步骤②需加入的试剂A是HCl(填化学式).
(3)步骤③通入的气体B是C12(填化学式),写出该反应的化学方程式2FeCl2+C12=2FeCl3.
(4)为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数.
分析 废腐蚀液加入过量铁粉过滤得到滤渣为铁和铜,加入过量试剂A为盐酸,过滤得到滤液2为氯化亚铁溶液,和滤液1合并通入氯气氧化氯化亚铁得到氯化铁溶液,
(1)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;
(2)滤渣中含有Fe和Cu,除去其中的Fe选用盐酸;
(3)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液;
(4)根据生成的氢气求出Fe的量,再求出铜的量,再求质量分数.
解答 解:(1)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;CuCl2与铁粉反应的离子方程式为:Fe+Cu2+=Fe2++Cu;FeCl3与铁粉反应的离子方程式为:2Fe3+++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)滤渣中含有Fe和Cu,若要除去其中的Fe选用盐酸,然后过滤,
故答案为:HCl;
(3)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液,其反应的化学方程式为:2FeCl2+C12=2FeCl3,
故答案为:C12;2FeCl2+C12=2FeCl3;
(4)取50g的滤渣与足量的HCl反应,得到5.6L氢气,则n(H2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,已知发生的反应方程式为Fe+2HC1=FeCl2+H2↑,所以n(Fe)=0.25mol,m(Fe)=nM=0.25mol×56g/mol=14g,则m(Cu)=50-14=36g,所以滤渣中铜的质量分数为$\frac{36g}{50g}$×100%=72%,
答:滤渣中铜的质量分数为72%.
点评 本题考查化学工艺流程、根据方程的计算、元素化合物性质等,掌握元素化合物的性质、混合物的分离、提纯方法是解决本题的关键,题目难度中等.

| A. | 除③外 | B. | 只有①⑤⑥⑧ | C. | 除③⑧外 | D. | 除③④⑦⑧ |
| A. | 大力开发可再生资源,可推广以乙醇汽油代替传统燃油技术 | |
| B. | 某些不合格建筑装饰材料,会缓慢释放甲醛、甲苯等有机物蒸气 | |
| C. | 食品加工消毒防腐常使用福尔马林 | |
| D. | 松花江水域的苯、硝基苯污染物可用活性炭吸附处理 |
 室温时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
室温时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | pH=4 的溶液中:c(Na+)+c(H+)-c(OH-)=0.1-c(CH3COOH) | |
| B. | W点表示的溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | pH=5的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)>c(CH3COOH)+c(OH-) |
| A. | 体积比为8:1 | B. | 分子个数之比为11:12 | ||
| C. | 密度之比为8:11 | D. | 原子个数之比为11:12 |
| A. | 尿素是一种氮肥 | B. | 尿素是人体新陈代谢的一种产物 | ||
| C. | 尿素能发生水解反应 | D. | 尿素是一种酸性物质 |
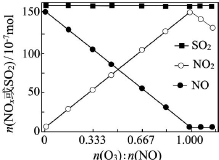 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: