题目内容
18.某物质溶于水,所得溶液既能使蓝色石蕊试液变红,也能与碳酸盐反应生成气体,此物质可能是①氧化物②盐③碱④单质⑤酸中的( )| A. | ①⑤ | B. | ①②④⑤ | C. | ② | D. | ①②③④⑤ |
分析 某物质溶于水,所得溶液既能使蓝色石蕊试纸变红,说明溶液呈酸性,也能与碳酸盐反应生成气体,证明酸性强于碳酸;
①氧化物如SO2溶于水生成亚硫酸;
②盐可以是酸式盐如NaHSO4,显酸性和碳酸盐反应生成二氧化碳;
③碱不能使石蕊试纸变红;
④单质Cl2溶于水生成盐酸和次氯酸;
⑤酸符合要求.
解答 解:①氧化物如SO2溶于水生成亚硫酸;所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,故正确;
②盐可以是酸式盐如NaHSO4,显酸性和碳酸盐反应生成二氧化碳;所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,故正确;
③碱不能使石蕊试纸变红;也不能与碳酸盐反应生成气体,故错误;
④单质Cl2溶于水生成盐酸和次氯酸;所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,故正确;
⑤酸符合要求;所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,故正确;
故选:B.
点评 本题考查了物质性质的应用,依据物质分类和具有的性质分析符合条件的反应现象,熟练掌握基础,解决问题.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.某溶液既能溶解A12O3,又能H2SiO3,在该溶液中可以大量共存的离子是( )
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
9.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3ˉ、NO3ˉ、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
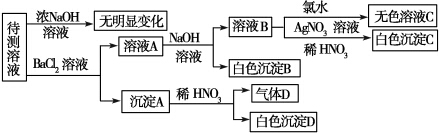
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
(2)待测溶液中是否有SO42-、SO32-中的一种或两种.若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,形成沉淀B时反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O.
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
3.如图曲线A和B是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )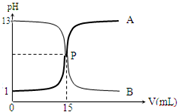

| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时可能未完全反应,溶液呈可能呈酸性也可能呈碱性 | |
| C. | 曲线A是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
7.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |
8.下列关于物质分类的说法正确的是( )
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题: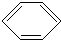 +Cl2
+Cl2
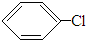 +HCl,反应类型取代反应.
+HCl,反应类型取代反应.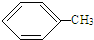 +3HO-NO2
+3HO-NO2
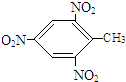 +3H2O,反应类型取代反应.
+3H2O,反应类型取代反应. +3H2
+3H2
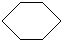 ,反应类型加成反应.
,反应类型加成反应. +Br2
+Br2
 +HBr,反应类型取代.
+HBr,反应类型取代.