题目内容
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3-、CO32-、Cl-、NO3-、SO42-中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成.经分析:反应后的溶液中的阴离子的种类没有变化.则下列说法不正确的是( )
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:若向原溶液中加入足量的盐酸,有气体生成;经分析知:反应后的溶液中的阴离子的种类没有变化,则原溶液中含有Cl-,一定没有HCO3-和CO32-;有气体生成则含有Fe2+和NO3-;
一共有五种离子,浓度均为0.1,Fe2+,Cl-,NO3-正好电荷守恒.说明存在的另外两种离子的带电量是一样的,则为Mg2+和SO42-,综上可知,溶液中存在的五种离子为:Fe2+、Cl-、NO3-、Mg2+和SO42-;结合选项分析.
一共有五种离子,浓度均为0.1,Fe2+,Cl-,NO3-正好电荷守恒.说明存在的另外两种离子的带电量是一样的,则为Mg2+和SO42-,综上可知,溶液中存在的五种离子为:Fe2+、Cl-、NO3-、Mg2+和SO42-;结合选项分析.
解答:
解:A、若向原溶液中加入过量的稀硫酸和KSCN溶液,Fe2+与NO3-、H+反应生成Fe3+,溶液显血红色,故A正确;
B、由以上分析可知,原溶液中一定不含有HCO3-和CO32-,故B正确;
C、由以上分析可知,原溶液中一定不含Ba2+和Al3+,故C错误;
D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体为MgO和Fe2O3,其物质的量分别为0.1mol和0.05mol,则总质量为0.1mol×40g/mol+0.05mol×160g/mol=12g,故D正确,
故选C.
B、由以上分析可知,原溶液中一定不含有HCO3-和CO32-,故B正确;
C、由以上分析可知,原溶液中一定不含Ba2+和Al3+,故C错误;
D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体为MgO和Fe2O3,其物质的量分别为0.1mol和0.05mol,则总质量为0.1mol×40g/mol+0.05mol×160g/mol=12g,故D正确,
故选C.
点评:本题考查了离子反应、离子检验方法和离子性质的分析判断,反应现象的判断是解题的依据,注意干扰离子的分析判断,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
现由含硫酸镁和泥沙的粗食盐提纯氯化钠,可将粗食盐溶于水,然后进行下列操作:①过滤②加过量氢氧化钠溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥蒸发结晶正确的操作顺序是( )
| A、②④⑤①③⑥ |
| B、⑤④②①③⑥ |
| C、⑤④②③①⑥ |
| D、②④⑤①③⑥ |
0.5L AlCl3溶液中Cl-为1.5mol.则AlCl3溶液的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
能说明0.1mol.L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大;②溶液的pH<7;③溶液中c(Na+)=c(A2-);④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
①稀释时,溶液中c(OH-)增大;②溶液的pH<7;③溶液中c(Na+)=c(A2-);④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
| A、①②③④ | B、①②③ |
| C、.①③ | D、②④ |
“处处清丝绕山涯,雾霭妖娆思故人”.这本是古代文人描写清晨美景的诗句,但在今天,“雾霭”不在,“雾霾”却成为环境问题的代名词.汽车尾气是形成雾霾的一个很重要的因素,据研究,汽车尾气无害化处理反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.下列说法不正确的是( )
| A、升高温度可使用该反应的逆反应速率降低 |
| B、使用高效催化剂可有效提高正反应速率 |
| C、反应达到平衡后,v(NO)≠v(N2) |
| D、增大压强有利于平衡向正反应方向进行 |
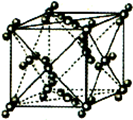 已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.
已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.