题目内容
4.下列元素的原子半径最小的是( )| A. | N | B. | P | C. | Se | D. | Te |
分析 同周期元素随原子序数增大而原子半径减小,不同周期元素,电子层数越多原子半径越大,据此判断.
解答 解:同周期元素随原子序数增大而原子半径减小,不同周期元素,电子层数越多原子半径越大,故原子半径Te>Se>P>N,故N原子半径最小,
故选A.
点评 本题考查原子半径比较,题目难度不大,注意对元素周期律的理解掌握,知道同一周期、同一主族元素原子半径大小比较方法,知道离子半径比较方法.

练习册系列答案
相关题目
2.在密闭容器中进行X2(g)+Y2(g)?2Z2(g),若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,当反应达到平衡后各物质的浓度不可能是( )
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
19.粗铜中一般含有锌、铁、银、金等杂质.在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯铜电极质量增加了3.2g.在此过程中,下列说法正确的是( )

| A. | 乙池中CuSO4溶液的浓度不变 | |
| B. | 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| C. | 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 | |
| D. | 甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ |
13.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式: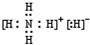 .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为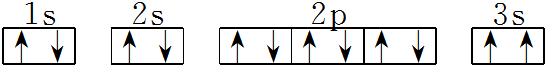 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
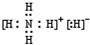 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.