题目内容
5.(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒物质.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则该反应的热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ•mol-1 ;
(2)NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.
I.100℃时,1mol NO2与1mol SO2的混合气体置于绝热恒容密闭容器中发生上述反应,
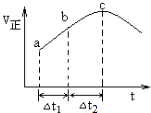
①下列说法正确的是CE(填字母);
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
E.当反应达到平衡时,继续充入1mol NO2,则NO的体积分数将变小
②判断此反应达到平衡的标志是ADEF;
A.体系的压强不再发生变化 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.各组分的物质的量浓度不再改变
E.体系的温度不再发生变化 F.v(NO2)正=v(NO)逆
II.在常温时,维持体系总压强p恒定,体积为V升的1mol NO2与1mol SO2的混合气体于密闭容器中发生上述反应.已知NO2的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{{a}^{2}}{(1-a)^{2}}$(用α、V等符号表示);
(3)熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.试回答下列问题:
①该燃料电池正极电极反应式为:O2+2CO2+4e-=2CO32-;
②25℃时,某学生想用该燃料电池电解一定量的硫酸钠饱和溶液,当电路中有a mol电子转移,溶液中析出mg Na2SO4•10H2O晶体.若温度不变,在剩余溶液中溶质的质量分数为$\frac{71m}{161(m+9a)}$×100%,消耗掉的丁烷在标准状况下的体积为0.86a.
分析 (1)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律可得:③×2-①-②,由此分析解答;
(2)①A.反应在达到平衡状态时,反应速率应保持不变;
B.随着反应的进行,反应物浓度越来越小;
C.根据图可知,该反应在绝热条件下进行,反应速率受温度和浓度的因素影响,反应速率先增大后减小,说明该反应为放热反应,先由于温度升高反应速率增大,后浓度下降,反应速率下降,所以反应物的总能量高于生成物的总能量;
D.根据图可知,ab段的速率小于bc段,所以△t1=△t2时,SO2的消耗量:a~b段小于b~c段;
E.当反应达到平衡时,继续充入1mol NO2,平衡正向浓度,但转化的二氧化氮远远小于加入的二氧化氮;
②该反应为气体体积不变的放热反应,在绝热的条件下进行,则体系的温度是不断升高的,直至平衡状态,根据平衡状态的特征:正逆反应速率相等,各组份的分数或浓度保持不变,及某些外部特征不变判断反应是否处于平衡状态;
II.根据反应NO2+SO2?SO3+NO,利用三段式,根据K=$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$计算;
(3)①某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,则正极电极为氧气发生还原反应生成碳酸根离子;
②电解硫酸钠饱和溶液即电解水,所以当电路中有amol电子转移时,消耗的水的质量为 $\frac{a}{2}$×18g=9ag,结合析出的mgNa2SO4•10H2O晶体,可计算出原饱和溶液的溶质的质量分数,剩余溶液中溶质的质量分数与原饱和溶液的溶质的质量分数相等,根据原池的负极反应C4H10-26e-+13CO32-=17CO2+5H2O可知,当电路中有amol电子转移时,消耗掉的丁烷的物质的量为$\frac{a}{26}$mol.
解答 解:(1)N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1①
2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1②
C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1③
根据盖斯定律可得:③×2-①-②,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol;
(2)I.①A.反应在达到平衡状态时,反应速率应保持不变,故A错误;
B.随着反应的进行,反应物浓度越来越小,所以反应物浓度:a点大于b点,故B错误;
C.根据图可知,该反应在绝热条件下进行,反应速率受温度和浓度的因素影响,反应速率先增大后减小,说明该反应为放热反应,先由于温度升高反应速率增大,后浓度下降,反应速率下降,所以反应物的总能量高于生成物的总能量,故C正确;
D.根据图可知,ab段的速率小于bc段,所以△t1=△t2时,SO2的消耗量:a~b段小于b~c段,故D错误;
E.当反应达到平衡时,继续充入1mol NO2,平衡正向浓度,但转化的二氧化氮远远小于加入的二氧化氮,NO的浓度减小,故E正确;
故选CE;
②该反应为气体体积不变的放热反应,在绝热的条件下进行,则体系的温度是不断升高的,直至平衡状态,
A.根据上面的分析可知,反应过程中温度升高,体积不变,则体系压强增大,当体系的压强不再发生变化,则说明反应已经处于平衡状态,故A正确;
B.该反应体积不变,质量守恒,所以混合气体的密度不随反应的进行而改变,故不能作为平衡状态的判断标志,故B错误;
C.反应前后质量和物质的量都不变,所以混合气体的平均相对分子质量不能作为平衡状态的判断标志,故C错误;
D.各组分的物质的量浓度不再改变,则反应处于平衡状态,故D正确;
E.根据上面的分析可知,体系的温度不再发生变化,反应处于平衡状态,故E正确;
F.v(NO2)正=v(NO)逆,则反应处于平衡状态,故F正确;
故选ADEF;
II.由于反应中各物质的计量数都是1,且在同一个容器进行反应,所以各物质的浓度关系就可以用物质的量表示,利用三段式,
NO2+SO2?SO3+NO
起始 1 1
转化 α α α α
平衡 1-α 1-α α α
所以K=$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$=$\frac{{a}^{2}}{(1-a)^{2}}$,
故答案为:$\frac{{a}^{2}}{(1-a)^{2}}$;
(3)①某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,则正极电极为氧气发生还原反应生成碳酸根离子,电极反应式为O2+CO2+2e-=CO32-,
故答案为:O2+CO2+2e-=CO32-;
②电解硫酸钠饱和溶液即电解水,所以当电路中有amol电子转移时,消耗的水的质量为 $\frac{a}{2}$×18g=9ag,结合析出的mgNa2SO4•10H2O晶体,所以原饱和溶液的溶质的质量分数为$\frac{\frac{142}{322}×m}{9a+m}$×100%=$\frac{71m}{161(m+9a)}$×100%,剩余溶液中溶质的质量分数与原饱和溶液的溶质的质量分数相等,也为$\frac{71m}{161(m+9a)}$×100%,根据原池的负极反应C4H10-26e-+13CO32-=17CO2+5H2O可知,当电路中有amol电子转移时,消耗掉的丁烷的物质的量为$\frac{a}{26}$mol,其体积为$\frac{a}{26}$mol×22.4L/mol=0.86aL,
故答案为:$\frac{71m}{161(m+9a)}$×100%;0.86a.
点评 本题考查化学平衡计算、原电池和电解池原理,明确化学反应原理及各个物理量的关系是解本题关键,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体化学问题,注意化学平衡计算中三段式的计算方法,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
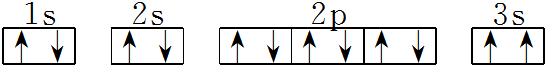 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.
| A. | 1mol NH4+和1mol OH-所含电子数均为10NA | |
| B. | 14gC2H4和14gC3H6 所含原子数均为3NA | |
| C. | 1L l mol/LH2SO4溶液与足量Zn充分反应生成22.4L H2 | |
| D. | 标准状况下,11.2LSO3所含分子数为0.5NA |
| A. | Al2(SO4)3 | B. | Na2CO3 | C. | AlCl3 | D. | KNO3 |