题目内容
海洋是资源的宝库,用海水可生产食盐和金属钠、镁及其它们的化合物等物质.
(1)海水提取镁及其化合物的过程如下:
①贝壳主要成分的化学式 .
②第④步反应的化学方程式 .
③在以上提取镁的过程中,没有涉及的化学反应类型是 .
A.分解反应 B.化合反应C.复分解反应 D.置换反应
④Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些材料因含有Mg(OH)2而具有阻燃性.Mg(OH)2能够阻燃的主要原因为 .
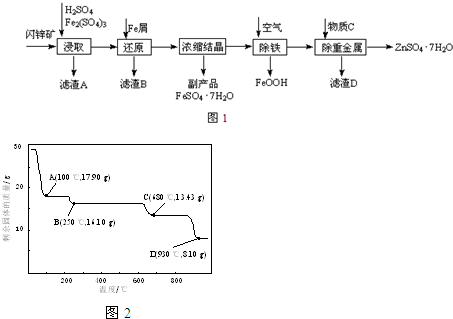
(2)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图1:
①生成沉淀X的化学方程式为 .
②循环Ⅱ中循环利用的物质是 (写化学式).
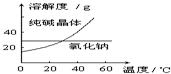
③在主产品中通常还含有少量的小苏打.现取样品少许溶于水,向溶液中滴加稀盐酸(边滴边震荡,假设生成的气体完全逸出),记录生成的二氧化碳体积和消耗盐酸的体积并绘制图象如图2,则样品中纯碱和小苏打的物质的量之比为 .
(1)海水提取镁及其化合物的过程如下:

①贝壳主要成分的化学式
②第④步反应的化学方程式
③在以上提取镁的过程中,没有涉及的化学反应类型是
A.分解反应 B.化合反应C.复分解反应 D.置换反应
④Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些材料因含有Mg(OH)2而具有阻燃性.Mg(OH)2能够阻燃的主要原因为
(2)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图1:

①生成沉淀X的化学方程式为
②循环Ⅱ中循环利用的物质是
③在主产品中通常还含有少量的小苏打.现取样品少许溶于水,向溶液中滴加稀盐酸(边滴边震荡,假设生成的气体完全逸出),记录生成的二氧化碳体积和消耗盐酸的体积并绘制图象如图2,则样品中纯碱和小苏打的物质的量之比为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)海水经蒸发后母液中含有氯化镁等物质,贝壳主要成分为碳酸钙,煅烧生成氧化钙,氧化钙和水反应生成氢氧化钙,加入到母液中可生成氢氧化镁,过滤后加入盐酸,可生成氯化镁,蒸发浓缩得到氯化镁结晶水合物,在酸性条件下脱水得到氯化镁,电解熔融的氯化镁可得到镁;
(2)联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,沉淀池中得到的为碳酸氢钠,加热分解生成碳酸钠;
主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,以此解答该题.
(2)联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,沉淀池中得到的为碳酸氢钠,加热分解生成碳酸钠;
主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,以此解答该题.
解答:
解:(1)海水经蒸发后母液中含有氯化镁等物质,贝壳主要成分为碳酸钙,煅烧生成氧化钙,氧化钙和水反应生成氢氧化钙,加入到母液中可生成氢氧化镁,过滤后加入盐酸,可生成氯化镁,蒸发浓缩得到氯化镁结晶水合物,在酸性条件下脱水得到氯化镁,电解熔融的氯化镁可得到镁
①贝壳主要成分为碳酸钙,化学式为CaCO3,故答案为:CaCO3;
②氢氧化镁与盐酸反应生成氯化镁和水,反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O,故答案为:Mg(OH)2+2HCl=MgCl2+2H2O;
③把贝壳制成石灰乳,涉及反应:CaCO3
CaO+CO2↑、CaO+H2O═Ca(OH)2,分别属于分解反应、化合反应;在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,涉及反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,属于复分解反应;将沉淀物与盐酸反应,结晶、过滤、干燥产物,涉及反应:Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2?6H2O
MgCl2+6H2O,分别属于复分解反应、分解反应;将产物电解得到金属镁,涉及反应:MgCl2
Mg+Cl2↑,属于分解反应;没有涉及的反应为置换反应,
故答案为:D;
④Mg(OH)2受热分解吸热,生成氧化镁熔点高且不能燃烧,可用于阻燃,故答案为:Mg(OH)2受热分解吸热,生成氧化镁熔点高且不能燃烧;
(2)①沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
②在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故答案为:CO2;
③假设纯碱为xmol,碳酸氢钠为ymol,涉及反应为Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O,
由图象可知,Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O
4mol 4mol 5mol 5mol
可知x=4mol,y=5mol-4mol=1mol,则纯碱和小苏打的物质的量之比为4:1,
故答案为:4:1.
①贝壳主要成分为碳酸钙,化学式为CaCO3,故答案为:CaCO3;
②氢氧化镁与盐酸反应生成氯化镁和水,反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O,故答案为:Mg(OH)2+2HCl=MgCl2+2H2O;
③把贝壳制成石灰乳,涉及反应:CaCO3
| ||
| ||
| ||
故答案为:D;
④Mg(OH)2受热分解吸热,生成氧化镁熔点高且不能燃烧,可用于阻燃,故答案为:Mg(OH)2受热分解吸热,生成氧化镁熔点高且不能燃烧;
(2)①沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
②在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故答案为:CO2;
③假设纯碱为xmol,碳酸氢钠为ymol,涉及反应为Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O,
由图象可知,Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O
4mol 4mol 5mol 5mol
可知x=4mol,y=5mol-4mol=1mol,则纯碱和小苏打的物质的量之比为4:1,
故答案为:4:1.
点评:本题主要考查物质的分离、提纯,为高频考点,侧重于联合制碱法的原料、反应式以及副产物的回收利用,题目有利于培养学生良好的科学素养,难度中等.

练习册系列答案
相关题目
加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数( )
| A、42% | B、58% |
| C、36% | D、64% |
 氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下: