题目内容
7.城市居民所用的液化石油气成分为丁烷,在使用过程中常有一些杂质以液态形式沉积于钢瓶底部,这些杂质可能是( )| A. | 丙烷 | B. | 乙烷和丙烷 | C. | 乙烷和甲烷 | D. | 戊烷和己烷 |
分析 烃类根据含碳数,常温常压下1~4为气态,4~15为液态.如果加压使得丁烷成为液化气,那么含碳数在丁烷(4)以上的烃均为液态,沉积物的含碳数一定大于等于4.据此分析.
解答 解:常温常压下1~4为气态,4~15为液态.气态的丁烷都被燃烧了,而戊烷和己烷因为是常温常压下液态,所以钢瓶中剩余的物质最有可能是戊烷和己烷.故选D.
点评 本题考查物质的沸点状态与原子数的关系,难度不大,掌握物质的沸点越低,越容易挥发,沸点越高,越不容易挥发是解题的关键.

练习册系列答案
相关题目
9.欲用胆矾(CuSO4•5H2O)配制480mL 0.1mol.L-1的CuSO4溶液.下列说法正确的是( )
| A. | 配制该溶液应用托盘天平称取12.5g胆矾 | |
| B. | 配制该溶液应用托盘天平称取8.0g胆矾 | |
| C. | 转移溶液前容量瓶内有少量蒸馏水会使所配溶液浓度偏低 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
10.可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A. | 氯化铁溶液 饱和溴水 | B. | 碳酸钠溶液 饱和溴水 | ||
| C. | 酸性高锰酸钾溶液 饱和溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
7.为了尽可能准确量取50mL某溶液,应选用的仪器是( )
| A. | 50mL烧杯 | B. | 25mL量筒 | C. | 100mL容量瓶 | D. | 500mL量杯 |
12.海水资源的利用具有广阔前景.海水中主要离子的含量如下表所示.
利用海水可以提取溴和镁,提取过程如下.
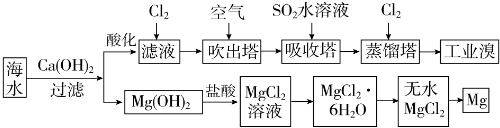
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
19.下列烷烃中沸点最高的是( )
| A. | 乙烷 | B. | 正戊烷 | C. | 正丁烷 | D. | 新戊烷 |
16.设NA表示阿伏加德罗常数的数值,下列说法中错误的是( )
| A. | 32 g O2所含的分子数目为NA | |
| B. | 1 mol H2O含有的H2O分子数目为NA | |
| C. | 1 mol H2O含有的氢原子数目为NA | |
| D. | 0.5NA个O2分子的物质的量是0.5 mol |
17.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡与硫酸反应:OH-+H+═H2O | |
| B. | NaOH溶液中通入少量二氧化碳:CO2+OH-═HCO3- | |
| C. | 氧化铁与盐酸混合:Fe2O3+6H+═2Fe3++3H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:OH-+H+═H2O |
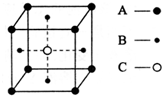 根据题意回答下列问题
根据题意回答下列问题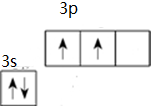 .
.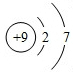 .
.