题目内容
12.(1)p电子的原子轨道呈纺锤形;(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为轴对称
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是As,最高价氧化物对应的水化物的化学式H3AsO4
(4)用“>”或“<”填空:①能量:4P<5S ②离子半径:F->Na+.
分析 (1)s轨道为球形;p轨道是纺锤形;
(2)σ键以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴呈圆柱形分布的;
(3)根据元素位于元素周期表中第四周期,第VA族,则元素为砷,然后写出元素符号以及最高价氧化物对应的水化物;
(4)①离原子核越远的能量越高,能层越大的能量越高;
②相同电子层结构的不同微粒,原子序数越小半径越大.
解答 解:(1)s电子的原子轨道呈球形,p电子的原子轨道呈纺锤形;
故答案为:纺锤;
(2)σ键以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴对称,
故答案为:轴对称;
(3)元素位于元素周期表中第四周期,第VA族,则元素为砷,砷的元素符号为As,最高价氧化物对应的水化物为H3AsO4,
故答案为:As;H3AsO4;
(4)①离原子核越远的能量越高,能层越大的能量越高,故能量:4P<5S,
故答案为:<;
②相同电子层结构的不同微粒,原子序数越小半径越大,故离子半径:F->Na+,
故答案为:>.
点评 本题考查了原子核外电子轨道伸展方向、元素在周期表中的位置、能量高低比较、微粒半径比较,注意区分轨道的形状,明确第四周期元素的位置即可解答,属于基础题,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.Na2CO3和NaHCO3是金属钠常见的两种碳酸盐,它们广泛地应用于生产和生活中.下列有关碳酸钠和碳酸氢钠的说法中,不正确的是( )
| A. | NaHCO3能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 | |
| B. | NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 | |
| C. | Na2CO3溶液中混有NaHCO3时,用给溶液加热的方法不能除去 | |
| D. | 往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀,由此可说明Na2CO3的溶解度比NaHCO3大 |
20.下列化学用语表达正确的是( )
| A. | 一氯乙烷的结构式CH3Cl | B. | 乙醇分子的比例模型: | ||
| C. | N2的电子式: | D. | 苯的分子式C6H6 |
17.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡与硫酸反应:OH-+H+═H2O | |
| B. | NaOH溶液中通入少量二氧化碳:CO2+OH-═HCO3- | |
| C. | 氧化铁与盐酸混合:Fe2O3+6H+═2Fe3++3H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:OH-+H+═H2O |
4.下列有关物质“量”的说法正确的是( )
| A. | 相同物质的量的Al和A1(OH)3分别与等浓度的NaOH溶液反应,至体系中均无固体时,Al(OH)3消耗的碱量较多 | |
| B. | 反应N2O4+N2H4→N2+H2O中,若有1molN2O4参加反应,则有4mol电子发生转移 | |
| C. | 由Na2CO3和NaHCO3组成的混合物中,若n(Na+):n(C)=7:5,则n(Na2CO3):n(NaHCO3)=2:3 | |
| D. | 相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的两相同 |
2.将ag二氧化锰粉末加入cL bmol•L-1的浓盐酸中,加热完全溶解,反应中转移电子d个.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 可以收集到标准状况下氯气5.6bcL | |
| B. | 反应后Cl-数目为bc-d | |
| C. | NA可表示为$\frac{2a}{87d}$ | |
| D. | 反应后溶液中的H+的物质的量为(bc-$\frac{2d}{{N}_{A}}$)mol |
 根据题意回答下列问题
根据题意回答下列问题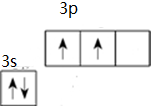 .
.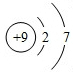 .
. 将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程)
将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程)