题目内容
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K’,则K’与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{k}$(2)下列各项能说明合成氨反应已达到平衡状态的是ce(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AD(填选项字母).
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序正确的是A(填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
分析 (1)①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
②Ⅰ、N2(g)+3H2(g)?2NH3(g),Ⅱ、$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),Ⅱ=$\frac{1}{2}$×Ⅰ,则K′=$\sqrt{k}$;
(2)根据化学平衡时:正逆反应速率相等,各组分含量保持不变判断;
(3)根据化学平衡的三段式列式计算出氢气的转化率;根据影响化学平衡的条件分析判断以及增大一种物质的浓度会提高另一种物质的转化率;
(4)①根据铵根离子的水解产物是氨水和氢离子来书写水解方程式;
②盐酸肼水溶液中水解原理与NH4Cl类似,N2H62+离子水解溶液显酸性.
解答 解:(1)①因该反应是放热反应,反应随着温度的升高,平衡逆向移动,故K1>K2,
故答案为:>;
②Ⅰ、N2(g)+3H2(g)?2NH3(g),K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
Ⅱ$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),K′=$\frac{c(N{H}_{3})}{{c}^{\frac{1}{2}}({N}_{2})•{c}^{\frac{3}{2}}({H}_{2})}$,
因为,Ⅱ=$\frac{1}{2}$×Ⅰ,则K′=$\sqrt{k}$;
故答案为:D;
(2)a.容器内参与反应的N2、H2、NH3的浓度之比为1:3:2,平衡时无此特征,故错误;
b.v(N2)(正)=$\frac{1}{3}$v(H2)(逆)化学平衡,故错误;
c.反应气体分子数减少,容器内压强会减小,保持不变时,化学平衡,故正确;
d.混合气体的总质量不变,恒容容器气体体积不变,密度始终保持不变,故错误;
e.混合气体的总质量不变,气体总的物质的量变小,平均摩尔质量变大,不变时,化学平衡,故正确;
故答案为:ce;
(3)N2(g)+3H2(g)?2NH3(g)
起始量(mol) 0.3 0.5 0
变化量(mol) x 3x 2x
平衡量(mol) 0.3-x 0.5-3x 2x
容器内气体压强变为原来的$\frac{7}{8}$,即气体的物质的量变为为原来的$\frac{7}{8}$,$\frac{2x+0.5-3x+0.3-x}{0.3+0.5}$=$\frac{7}{8}$,解得x=0.05,H2的转化率为$\frac{0.15}{0.5}×100%$=30%;
A.向容器中按原比例再充入原料气,相当于增大容器内的压强,平衡正向进行,提高氢气的转化率,故A正确;
B.向容器中再充入一定量H2,提高了N2的转化率,而本身的转化率降低,故B错误;
C.改变反应的催化剂,不改变化学平衡,不能提高氢气转化率,故C错误;
D.液化生成物分离出氨,减少生成物,平衡正向进行,提高氢气转化率,故D正确;
故答案为:30%;A D;
(4):①盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似,由N2H4联想到NH3,由N2H6Cl2联想到NH4Cl,再注意到N2H6是二元碱而NH3是一元的,则盐酸肼第一步水解反应的离子方程式为N2H62++H2O?[N2H5•H2O]++H+;
故答案为:N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中水解原理与NH4Cl类似,N2H62+离子水解溶液显酸性;
A、溶液中离子浓度大小为:c(Cl-)>c(N2H62+)>c(H+)>c(OH-),故A正确;
B、依据化学式可知N2H6Cl2,溶液中氯离子浓度大于N2H62+,故B错误;
C、依据溶液中质子数守恒分析,计算式错误,故C错误;
D、依据化学式可知N2H6Cl2,溶液中氯离子浓度大于N2H62+,故D错误;
故答案为:A.
点评 本题考查了化学平衡常数K与可逆反应的关系、化学平衡的有关计算、化学平衡状态的判断、盐类水解的分析应用、电解质溶液中离子浓度大小比较方法、电荷守恒和质子守恒的分析判断,掌握基础注意类推应用是关键,题目难度中等.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | 醋酸钠中加入盐酸:CH3COONa+H+→CH3COOH+Na+ | |
| B. | 在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH | |
| C. | 甲醛溶液中加入足量的银氨溶液并加热: HCHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| D. | 2分子甘氨酸 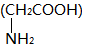 在一定条件下脱去2分子水: 在一定条件下脱去2分子水: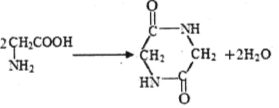 |
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
(2)在容积可变的密闭容器中充入1molCO(g)和2molH2(g)进行CO(g)+2H2(g)?CH3OH(g)生
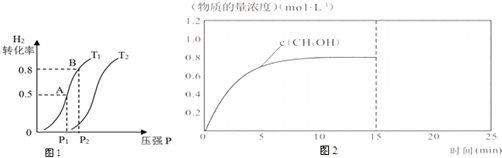
成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4 L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO(g)和6molH2(g)生成CH3OH(g)反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率0.16mol/(L•min);若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ•mol-1中的相关化学键能如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | x | 465 | 413 |
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料.在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ•mol-1.向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如图1中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是使用催化剂.
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)=0.10mol•L-1•min-1.
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=2L•mol-1.在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正)< v(逆) (填“>”“<”“﹦”),原因是浓度商Qc=$\frac{1.5}{0.5•1}$=3>2=K反应向逆方向进行,故v(正)<v(逆).
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1>T3(填“>”“<”“﹦”),判断的理由是此反应为放热反应,降温,平衡向正向进行(或反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高).
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2.某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图2所示,利用以下反应填空:
NO+CO?N2+CO2(有CO) 2NO?N2+O2(无CO)
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为此反应为放热反应,升高温度反应更有利于向逆反应方向进行.
②在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制最佳温度在870℃左右.
 NO
NO  HNO3
HNO3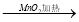 Cl2
Cl2  漂白粉
漂白粉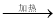 无水MgCl2
无水MgCl2  Mg
Mg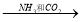 NaHCO3
NaHCO3 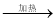 Na2CO3
Na2CO3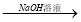 NaAlO2溶液
NaAlO2溶液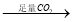 Al(OH)3
Al(OH)3 Al2O3
Al2O3  Al
Al