题目内容
4.甲醇是21世纪应用最广泛的清洁燃料之一,通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(l)△H| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
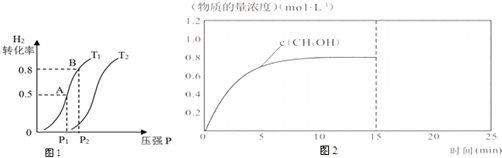
(2)在容积可变的密闭容器中充入1molCO(g)和2molH2(g)进行CO(g)+2H2(g)?CH3OH(g)生
成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4 L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO(g)和6molH2(g)生成CH3OH(g)反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率0.16mol/(L•min);若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
分析 (1)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律计算反应CO ( g )+2H2 ( g )?CH3OH ( l )的焓变,写出热化学方程式;
(2)①反应自发进行的判断依据是△H-T△S<0,据此分析判断,压强一定温度越高平衡逆向进行,氢气的转化率减小;
②在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),A点氢气转化率0.5,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
B点和A点温度不变平衡常数不变,结合三行计算列式计算平衡浓度,结合平衡常数计算气体体积;
③增加甲醇产率需要平衡正向进行,注意容器为恒温恒压容器;
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),图中中是甲醇的浓度增加,达到平衡状态甲醇浓度为0.8mol/L,据此计算甲醇反应速率,速率之比等于化学方程式计量数之比得到氢气的反应速率,计算平衡状态下CO的浓度,若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,改变条件后依据氢气的转化率列三行计算,得到平衡状态下一氧化碳的浓度,据此画出图象变化.
解答 解:(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$×②得反应CO(g)+2H2(g)=CH3OH(l),
该反应的反应热△H=-283.0kJ•mol-1+(-285.8kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-128.1kJ•mol-1,
即CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ•mol-1.
故答案为:-128.1;
(2)①CO ( g )+2H2 ( g )?CH3OH ( l ),反应为放热反应,△H<0,气体体积减小反应的熵变△S<0,图象中压强一定随温度升高,平衡逆向进行,氢气转化率减小,则T1<T2,
故答案为:<;<;
②在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),A点氢气转化率0.5,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 1 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
平衡常数K=$\frac{\frac{0.5}{2}}{\frac{0.5}{2}×(\frac{1}{2})^{2}}$=4,
若达到平衡状态B 时转化率为0.8,结合平衡三行计算列式计算,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.8 1.6 0.8
平衡量(mol) 0.2 0.4 0.8
B点温度不变平衡常数不变,K=$\frac{\frac{0.8}{V(B)}}{\frac{0.2}{V(B)}×(\frac{0.4}{V(B)})^{2}}$=4
则容器的体积V(B)=0.4
故答案为:4,0.4;
③A.反应为放热反应,升高温度平衡逆向进行,甲醇产率减小,故A错误;
B.从平衡体系中及时分离CH3OH,平衡正向进行,甲醇产率增大,故B正确;
C.充入He总压增大分压不变,平衡不变,甲醇产率不变,故C错误;
D.体积可变的容器中再充入0.5mol CO和1mol H2 ,相当于压强增大,体积增大,最后得到相同的平衡状态,转化率不变,甲醇产率不变,故D错误;
故答案为:B;
(3)V(CH3OH)=$\frac{△c}{△t}$=$\frac{0.8mol/L}{10min}$=0.08mol/(L•min),
根据方程式得V(CH3OH):V(H2)=1:2,
所以V(H2)=2×0.08mol/(L•min)=0.16mol/(L•min);
2H2(g)+CO(g)=CH3OH(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 1.6 0.8 0.8
平衡量(mol/L) 1.4 0.2 0.8
此时CO的平衡浓度为 0.2mol/L,
改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=$\frac{6mol}{2L}$×33.3%=1mol/L,
2H2(g)+CO(g)=CH3OH(g)
起始浓度(1mol/L) 3 1 0
转化浓度(1mol/L) 1 0.5 0.5
平衡浓度(1mol/L) 2 0.5 0.5
CO平衡浓度为0.5mol/L,15min时CO浓度为0.2mol/L.升温平衡逆向进行,一氧化碳物质的量浓度增大,据此画出变化曲线为: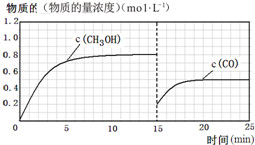 ,
,
故答案为:0.16mol•L-1•min-1;
点评 本题考考查了热化学方程式和盖斯定律计算应用,平衡常数的计算及应用,影响平衡的因素分析判断,题目涉及的知识点较多,综合性较强,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | △H>0 | |
| B. | 1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行 | |
| C. | 其他条件不变,向平衡体系充入CO2气体,K值减小 | |
| D. | 其他条件不变,升高温度,可以提高CO的平衡转化率 |
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K’,则K’与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{k}$(2)下列各项能说明合成氨反应已达到平衡状态的是ce(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AD(填选项字母).
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序正确的是A(填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| C. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| 选项 | 化学反应及其离子方程式 | 评 价 |
| A | 向沸腾的蒸馏水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O=Fe(OH)3↓+3H+ | 正 确 |
| B | 大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | 错误,产物不符合客观事实 |
| D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
| A. | A | B. | B | C. | C | D. | D |
 回答下列问题:
回答下列问题: