��Ŀ����
14�����û�ѧ��Ӧԭ���о�̼�����ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���壮��1����֪��ӦCO��g��+2H2��g��?CH3OH��g����H=-99kJ•mol-1�е���ػ�ѧ���������
| ��ѧ�� | H-H | C-O | C��O | H-O | C-H |
| E/��kJ•mol-1�� | 436 | 343 | x | 465 | 413 |
��2���״���Ϊһ����Ҫ�Ļ���ԭ�ϣ��ȿ�����Ϊȼ�ϣ��������ںϳ���������ԭ�ϣ���һ�������¿����ü״��ʻ�������ȡ����������䷴Ӧԭ���ɱ�ʾΪ��CH3OH��g��+CO��g��?HCOOCH3��g����H=-29.1kJ•mol-1�������Ϊ2L���ܱ������г���2mol CH3OH��g�� ��2mol CO����������ڵ�ѹǿ��p��kPa����ʱ�䣨min���ı仯��ϵ��ͼ1�Т�������ʾ��

�٢�͢���ȣ��ı�ķ�Ӧ������ʹ�ô�����
�ڷ�Ӧ����5minʱ�ﵽƽ�⣬�ڴ������´ӷ�Ӧ��ʼ���ﵽƽ��ʱv��HCOOCH3��=0.10mol•L-1•min-1��
�۷�Ӧ����2minʱ�ﵽƽ�⣬ƽ�ⳣ��K����=2L•mol-1����������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��2mol HCOOCH3��v�������� v���棩 �����������������������ԭ����Ũ����Qc=$\frac{1.5}{0.5•1}$=3��2=K��Ӧ���淽����У���v��������v���棩��
�ܱȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1��T3������������������������жϵ������Ǵ˷�ӦΪ���ȷ�Ӧ�����£�ƽ����������У���Ӧ���ƽ��ʱ�����ʱ��ȷ�Ӧ���ƽ��ʱ�����ʱ��̣���Ӧ���ʿ죬��T1�¶ȸ��ߣ���
��3�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㣮��ѧ�������о����ô�������β���е�NO��COת���CO2��N2��ij�о�С����ʵ������ij���ʹ�����CO��NO��ת�������о������NOת��ΪN2��ת�������¶ȡ�CO������ı仯�����ͼ2��ʾ���������·�Ӧ��գ�
NO+CO?N2+CO2����CO�� 2NO?N2+O2����CO��
������ʹ��CO���¶ȳ���775�棬����NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ�˷�ӦΪ���ȷ�Ӧ�������¶ȷ�Ӧ�����������淴Ӧ������У�
����$\frac{n��NO��}{n��CO��}$=1�������£�Ӧ��������¶���870�����ң�
���� ��1�����ݻ�ѧ��Ӧ���ʱ�=��Ӧ���ܼ���-�������ܼ��ܣ�
��2���٢�͢���ȣ���Ӧ���ʼӿ죬����ѧƽ��״̬һ����ӦΪ�Ӵ�����
��������HCOOCH3�����ʵ���Ϊx������ͬ��ͬ����������ѹǿ֮��=���ʵ���֮�ȼ���x������v=$\frac{��c}{��t}$���㣻
�۸��ݻ�ѧƽ�ⳣ���������K���ټ�����������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��2mol HCOOCH3���Qc����K�ȽϿɵã�
�ܸ����¶ȶԻ�ѧƽ�ⳣ����Ӱ���Ϸ�Ӧ�ȿɵã�
��3���ٴ˷�ӦΪ���ȷ�Ӧ�������¶ȷ�Ӧ�����������淴Ӧ�������
����ͼ��֪��$\frac{n��NO��}{n��CO��}$=1��870�����ң�NOת��ΪN2��ת�������
��� �⣺��1������H=436��2+x-3��413-343-465=-99kJ•mol-1�����x=1076��
�ʴ�Ϊ��1076��
��2���٢�͢���ȣ��ﵽƽ������ʱ��϶̣���Ӧ���ʼӿ죬����ѧƽ��״̬һ����ӦΪ�Ӵ�����
�ʴ�Ϊ��ʹ�ô�����
�������Ϊ2L���ܱ������г���2mol CH3OH��g�� ��2mol CO����Ӧ����5minʱ�ﵽƽ�⣬������HCOOCH3�����ʵ���Ϊx��������ʽ��
CH3OH��g��+CO��g��?HCOOCH3��g��
nʼ��2 2 0
nת��x x x
nƽ��2-x 2-x x
ͬ��ͬ����������ѹǿ֮��=���ʵ���֮�ȣ���$\frac{4}{2-x+2-x+x}=\frac{4}{3}$�����x=1����v��HCOOCH3��=$\frac{1mol��2L}{5min}$=0.10 mol•L-1•min-1��
�ʴ�Ϊ��0.10 mol•L-1•min-1��
�۷�Ӧ���뷴Ӧ���ƽ��״̬��ͬ����K=$\frac{1mol��2L}{��1mol��2L��•��1mol��2L��}$=2 L•mol-1�����������м���1mol CO��2mol HCOOCH3��ʱŨ����Qc=$\frac{3mol��2L}{��1mol��2L����2mol��2L��}$��=3��2=K����Ӧ���淽����У���v��������v���棩��
�ʴ�Ϊ��2 L•mol-1������Ũ����Qc=$\frac{1.5}{0.5•1}$=3��2=K ��Ӧ���淽����У���v��������v���棩��
�ܴ˷�ӦΪ���ȷ�Ӧ�����£�ƽ����������У�
�ʴ�Ϊ�������˷�ӦΪ���ȷ�Ӧ�����£�ƽ����������У���Ӧ���ƽ��ʱ�����ʱ��ȷ�Ӧ���ƽ��ʱ�����ʱ��̣���Ӧ���ʿ죬��T1�¶ȸ��ߣ���
��3���ٴ˷�ӦΪ���ȷ�Ӧ�������¶ȷ�Ӧ�����������淴Ӧ������У�NO�ķֽ��ʽ��ͣ�
�ʴ�Ϊ���˷�ӦΪ���ȷ�Ӧ�������¶ȷ�Ӧ�����������淴Ӧ������У�
����ͼ��֪��$\frac{n��NO��}{n��CO��}$=1��870�����ң�NOת��ΪN2��ת�������850�桫900��֮�䶼���ԣ���
�ʴ�Ϊ��870�棨��850�桫900��֮�䶼���ԣ���
���� ���⿼������뷴Ӧ�ȵĹ�ϵ����ѧƽ����йؼ��㡢Ӱ�컯ѧƽ������ء�ͼ��ķ����жϣ�ע�����֪ʶ�����գ���ͼ�������������Ŀ�Ѷ��еȣ�

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д���1���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��
N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
������ϳɰ���Ӧ�ķ���ʽдΪ$\frac{1}{2}$N2��g��+$\frac{3}{2}$H2��g��?NH3��g������ƽ�ⳣ��ΪK������K����K�Ĺ�ϵΪD������ĸ��
A��K��=K B��K��=2K C��K��=$\frac{1}{2}$K D��K��=$\sqrt{k}$��2�����и�����˵���ϳɰ���Ӧ�Ѵﵽƽ��״̬����ce������ĸ������Ӧ���ڹ̶�������ܱ������н��еģ�
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b��v��N2��������=3v��H2�����棩
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
e����������ƽ��Ħ����������
��3����0.3mol N2��0.5mol H2�������������ܱ������У���һ�������´ﵽƽ�⣬�������������ѹǿ��Ϊԭ����$\frac{7}{8}$����ʱH2��ת����Ϊ30%������߸�������H2��ת���ʣ����д�ʩ���е���AD����ѡ����ĸ����
A���������а�ԭ�����ٳ���ԭ���� B�����������ٳ���һ����H2
C���ı䷴Ӧ�Ĵ��� D��Һ��������������
��4�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ƣ�
��д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽN2H62++H2O�T[N2H5•H2O]++H+��
��������ˮ��Һ������Ũ�ȵ�����˳����ȷ����A������ţ���
A��c��Cl-����c��N2H62+����c��H+����c��OH-��
B��c��Cl-����c��[N2H5•H2O+]����c��H+����c��OH-��
C��2c��N2H62+��+c��[N2H5•H2O]+��+c��H+��=c��H+��+c��OH-��
D��c��N2H62+����c��Cl-����c��H+����c��OH-��
| A�� | HCl��aq��+NaOH ��aq���TNaCl ��aq��+H2O ��l����H��0 | |
| B�� | 2CH3OH ��l��+3O2 ��g���T2CO2 ��g��+4H2O ��l����H��0 | |
| C�� | 2FeCl3��aq��+Fe��s���T3FeCl3��aq����H��0 | |
| D�� | 2H2��g��+O2��g���T2H2O ��l����H��0 |
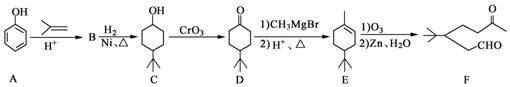
 ��
�� ��A��B�ķ�Ӧ����Ϊ�ӳɷ�Ӧ��
��A��B�ķ�Ӧ����Ϊ�ӳɷ�Ӧ�� ����дһ�֣���
����дһ�֣��� ����CH2=CH2Ϊԭ���Ʊ��л��� ��
����CH2=CH2Ϊԭ���Ʊ��л��� ��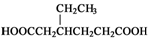 �ϳ�·������ͼ�����Լ����ã���
�ϳ�·������ͼ�����Լ����ã���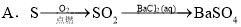
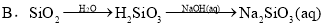

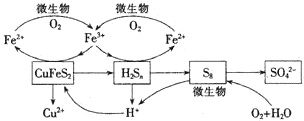 �ҹ���ͭ��Ҫȡ�Ի�ͭ��CuFeS2�������ſ�ʯƷζ�Ľ��ͺͻ���Ҫ�����ߣ�ʪ����ͭ����������ͻ�����ù��յĺ����ǻ�ͭ��Ľ�����Ŀǰ��Ҫ��������������λ����������������ַ�����
�ҹ���ͭ��Ҫȡ�Ի�ͭ��CuFeS2�������ſ�ʯƷζ�Ľ��ͺͻ���Ҫ�����ߣ�ʪ����ͭ����������ͻ�����ù��յĺ����ǻ�ͭ��Ľ�����Ŀǰ��Ҫ��������������λ����������������ַ�����