题目内容
6.下列化学方程式或离子方程式书写不正确的是( )| A. | 醋酸钠中加入盐酸:CH3COONa+H+→CH3COOH+Na+ | |
| B. | 在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH | |
| C. | 甲醛溶液中加入足量的银氨溶液并加热: HCHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| D. | 2分子甘氨酸 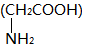 在一定条件下脱去2分子水: 在一定条件下脱去2分子水: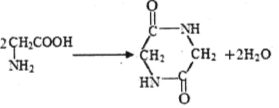 |
分析 A.醋酸为强电解质,应拆成离子形式,醋酸为弱酸,保留化学式;
B.乙烯与水加成生成乙醇;
C.甲醛中含2个-CHO,发生银镜反应生成碳酸铵、银、氨气和水;
D.氨基与羧基脱水生成肽键,2分子脱水形成环状结构.
解答 解:A.醋酸为强电解质,应拆成离子形式,醋酸为弱酸,保留化学式,离子方程式:CH3COO++H+→CH3COOH,故A错误;
B.在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH,故B正确;
C.甲醛中含2个-CHO,发生银镜反应生成碳酸铵、银、氨气和水,离子反应为HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O,故C错误;
D.2分子甘氨酸 脱去2分子水的反应为
脱去2分子水的反应为 ,故D正确;
,故D正确;
故选:AC.
点评 本题考查离子方程式、化学方程式的书写,为高频考点,明确官能团及其性质关系是解本题关键,知道常见有机物反应类型及特点、断键和成键方式,难点是甲醛和银氨溶液反应方程式的书写.

练习册系列答案
相关题目
19.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{{(CO)•({H_2})}}{{(CO)•({H_2}O)}}$,该反应为放热反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc
a.容器中压强不变 b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O) d.c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应 CO (g)+H2O (g)?CO2(g)+H2(g),得到如表三组数据:
①通过计算可知,CO的转化率实验A大于 实验B(填“大于”、“等于”或“小于”),该反应的正反应为放(填“吸”或“放”)热反应.
②若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是b=2a(用含a、b的数学式表示).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{{(CO)•({H_2})}}{{(CO)•({H_2}O)}}$,该反应为放热反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc
a.容器中压强不变 b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O) d.c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应 CO (g)+H2O (g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
②若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是b=2a(用含a、b的数学式表示).
2.高炉炼铁过程中发生反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | △H>0 | |
| B. | 1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行 | |
| C. | 其他条件不变,向平衡体系充入CO2气体,K值减小 | |
| D. | 其他条件不变,升高温度,可以提高CO的平衡转化率 |
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,其平衡常数K与温度T的关系如下表:
①试判断K1> K2(填写“>”“=”或“<”).
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K’,则K’与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{k}$(2)下列各项能说明合成氨反应已达到平衡状态的是ce(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AD(填选项字母).
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序正确的是A(填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K’,则K’与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{k}$(2)下列各项能说明合成氨反应已达到平衡状态的是ce(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AD(填选项字母).
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序正确的是A(填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)

 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( ) D.
D.
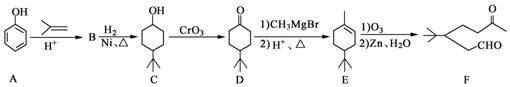
 .
. ,A到B的反应类型为加成反应.
,A到B的反应类型为加成反应. (任写一种).
(任写一种).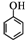 )和CH2=CH2为原料制备有机物 的
)和CH2=CH2为原料制备有机物 的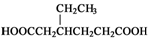 合成路线流程图(无机试剂任用).
合成路线流程图(无机试剂任用).