题目内容
下列物质的制备与工业生产相符的是
①NH3  NO
NO 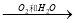 HNO3
HNO3
②浓HCl 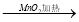 Cl2
Cl2  漂白粉
漂白粉
③MgCl2(aq) 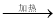 无水MgCl2
无水MgCl2  Mg
Mg
④饱和NaCl(aq) 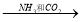 NaHCO3
NaHCO3 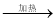 Na2CO3
Na2CO3
⑤铝土矿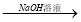 NaAlO2溶液
NaAlO2溶液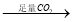 Al(OH)3
Al(OH)3 Al2O3
Al2O3  Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,其平衡常数K与温度T的关系如下表:
①试判断K1> K2(填写“>”“=”或“<”).
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K’,则K’与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{k}$(2)下列各项能说明合成氨反应已达到平衡状态的是ce(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AD(填选项字母).
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序正确的是A(填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K’,则K’与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{k}$(2)下列各项能说明合成氨反应已达到平衡状态的是ce(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.混合气体的平均摩尔质量不变
(3)将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AD(填选项字母).
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序正确的是A(填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
7.下列物质中只含有共价键的是( )
| A. | NaOH | B. | HCl | C. | NaCl | D. | K2SO3 |


 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )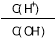 D.
D.
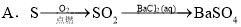
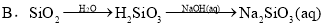
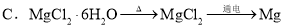

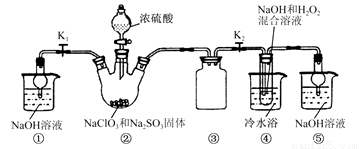
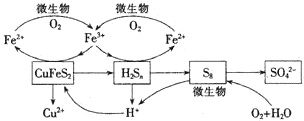 我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.
我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.