题目内容
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温下,14g CO和N2的混合物含的原子数为NA | |
| B. | 1mol Fe发生氧化反应失去的电子数一定是3NA | |
| C. | 0.1mol•L-1 NaCl溶液中含的Cl-数是0.1NA | |
| D. | 0.1mol H2SO4与1L 0.1mol•L-1 NaOH溶液反应,生成的H2O分子数是0.2NA |
分析 A、CO和氮气的摩尔质量均为28g/mol,且均为双原子分子;
B、铁反应后可能变为+2价,还可能变为+3价;
C、溶液体积不明确;
D、硫酸是二元酸,0.1mol硫酸能电离出0.2mol氢离子.
解答 解:A、CO和氮气的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且均为双原子分子,故0.5mol混合物中含NA个原子,故A正确;
B、铁反应后可能变为+2价,还可能变为+3价,故1mol铁发生氧化反应失去的电子不一定是3NA个,还可能为2NA个,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、硫酸是二元酸,0.1mol硫酸能电离出0.2mol氢离子,故0.1mol硫酸和1L0.1mol/L的氢氧化钠溶液即0.1mol氢氧化钠反应时,硫酸过量,只生成0.1mol水,故为0.1NA个水分子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
19.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA | |
| D. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA |
20.下列有关Na2CO3和NaHCO3的叙述错误的是( )
| A. | 水溶液都显碱性 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | NaHCO3比Na2CO3更易溶于水 | |
| D. | 与足量盐酸反应得到等量的CO2时,消耗NaHCO3的质量比Na2CO3的质量要少 |
17.下列叙述正确的是( )
| A. | 500mL 0.5mol•L-1 K2SO4溶液中,K+的总数为NA | |
| B. | 2L 0.5mol•L-1 K2SO4溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O中含有10NA个质子 | |
| D. | 2L水中溶有80g的氢氧化钠,溶液的物质的量浓度为2mol•L-1 |
4.将铜制印刷电路板置于过量的FeCl3溶液中,下列有关该过程的描述正确的是( )
| A. | 溶液中只含Cu2+、Fe2+、Fe3+ | B. | 溶液呈蓝色 | ||
| C. | 无固体析出 | D. | 发生了置换反应 |
6.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].常温下,在AG=-10的溶液中能大量共存的离子是( )
| A. | Ba2+、K+、Cl-、SO32- | B. | Na+、SiO32-、AlO2-、SO42- | ||
| C. | Na+、K+、HCO3-、S2- | D. | K+、NH4+、Fe3+、I- |
7.下列排列顺序正确的是( )
| A. | 稳定性:NH3<PH3<AsH3 | B. | 酸性:H2SO4>H3PO4>H2SiO3 | ||
| C. | 还原性:S 2-<Br -<Fe 2+ | D. | 电负性:Cl>P>S |
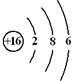 ,电子式表示化合物 C2D 的形成过程
,电子式表示化合物 C2D 的形成过程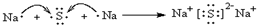 ;
;