题目内容
6.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].常温下,在AG=-10的溶液中能大量共存的离子是( )| A. | Ba2+、K+、Cl-、SO32- | B. | Na+、SiO32-、AlO2-、SO42- | ||
| C. | Na+、K+、HCO3-、S2- | D. | K+、NH4+、Fe3+、I- |
分析 AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$],常温下,在AG=-10的溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10,所以c(OH-)=0.01mol/L,该溶液显碱性,离子之间不能结合生成水、气体、沉淀、弱电解质,不能发生氧化还原反应等,则离子能共存,以此进行解答.
解答 解:常温下,在AG=-10的溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10,所以c(OH-)=0.01mol/L,该溶液显碱性,溶液中存在大量氢氧根离子,
A.Ba2+与SO32-反应生成亚硫酸钡沉淀,不能大量共存,故A错误;
B.Na+、SiO32-、AlO2-、SO42-之间不发生反应,都不与氢氧根离子反应,可大量共存,故B正确;
C.HCO3-与氢氧根离子反应,不能共存,故C错误;
D.Fe3+、I-之间发生氧化还原反应,NH4+、Fe3+与氢氧根离子反应,不能共存,故D错误;
故选B.
点评 本题考查离子的共存问题,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,明确信息得出溶液的酸碱性是解答本题的关键,并注意离子之间的氧化还原反应来解答,题目难度中等.

练习册系列答案
相关题目
8.用下列实验装置进行相应实验,能达到实验目的是( )
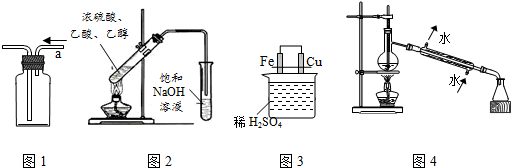

| A. | 用图1所示装置从a口进气可收集CH2=CH2 | |
| B. | 用图2所示装置制取并收集乙酸乙酯 | |
| C. | 用图3所示装置比较Fe、Cu的金属活动性 | |
| D. | 用图4所示装置进行石油的蒸馏实验 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,14g CO和N2的混合物含的原子数为NA | |
| B. | 1mol Fe发生氧化反应失去的电子数一定是3NA | |
| C. | 0.1mol•L-1 NaCl溶液中含的Cl-数是0.1NA | |
| D. | 0.1mol H2SO4与1L 0.1mol•L-1 NaOH溶液反应,生成的H2O分子数是0.2NA |
1.下列反应中,水既不是氧化剂又不是还原剂,但属于氧化还原反应的是( )
| A. | 2F2+H2O═4HF+O2 | B. | Si+2NaOH+H2O═Na2SiO3+2H2↑ | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | P2O5+3H2O═2H3PO4 |
11.几种短周期元素的原子半径及主要化合价如表:
已知,X、Y、Z和M均为第三周期元素.下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化 合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | Y的非金属性大于S,其含氧酸酸性一定强于H2SO4 | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | X、Z、M的单质分别与水反应,M最剧烈 | |
| D. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 |