题目内容
18. 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.(1)①氯胺(NH2Cl)的电子式为
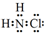 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s)?N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=0.003mol•L-1•min-1.
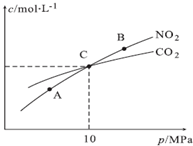
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)(填“<”或“>”或“=”).
②A、B、C三点中NO2的转化率最高的是A(填“A”或“B”或“C”)点.
分析 (1)①氯胺(NH2Cl)为共价化合物,NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),△H=反应物的键能之和-生成物的键能之和;
②NH2Cl与水反应生成强氧化性的物质,根据氧化还原化合价升降分析;
(2)①根据数据,在400℃时,甲乙容器,乙的充入量为甲的一半,随着反应的进行,在各个时间段内NO的浓度均比甲的一半还要大,说明该反应为放热反应,温度升高,平衡逆向移动;
②根据2NO(g)+C(s)?N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,为0.4mol;
(3)①A、B两点的温度相同,平衡常数只与温度有关,故浓度平衡常数关系:Kc(A)=Kc(B);
②2NO2(g)+2C(s)?N2(g)+2CO2(g),增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最高的是A点.
解答 解:(1)①氯胺(NH2Cl)为共价化合物,电子式为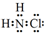 ,NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),△H=反应物的键能之和-生成物的键能之和=(3×391.3+243.0)-(2×391.3+191.2+431.8)=+11.3 kJ•mol-1,故答案为:
,NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),△H=反应物的键能之和-生成物的键能之和=(3×391.3+243.0)-(2×391.3+191.2+431.8)=+11.3 kJ•mol-1,故答案为: ;+11.3 kJ•mol-1;
;+11.3 kJ•mol-1;
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为NH2Cl+H2O?NH3+HClO,故答案为:NH2Cl+H2O?NH3+HClO;
(2)①根据数据,在400℃时,甲乙容器,乙的充入量为甲的一半,随着反应的进行,在各个时间段内NO的浓度均比甲的一半还要大,说明该反应为放热反应,温度升高,平衡逆向移动,故答案为:放热;
②根据2NO(g)+C(s)?N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,为0.4mol,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=$\frac{\frac{(1-0.4)mol}{1L}}{200min}$=0.003 mol•L-1•min-1,故答案为:0.003 mol•L-1•min-1;
(3)①A、B两点的温度相同,平衡常数只与温度有关,故浓度平衡常数关系:Kc(A)=Kc(B),故答案为:=;
②2NO2(g)+2C(s)?N2(g)+2CO2(g),增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最高的是A点,故答案为:A.
点评 本题考查了反应热的计算、化学平衡状态的判断、化学平衡移动以及化学平衡常数、化学方程式的书写等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| B. | 将80 g NaOH 溶于1L 水中,所得溶液中NaOH 的物质的量浓度为2mol/L | |
| C. | 18 g 水在标准状况下的体积为22.4 L | |
| D. | 在标准状况下,20 ml NH3与60 ml O2所含的分子数之比为1:3 |
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
 ,其阴阳离子个数比为1:2.
,其阴阳离子个数比为1:2.
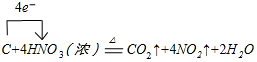 .
. 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.