题目内容
10. 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.已知FeCO3易被氧化:4FeCO3+6H2O+O2═4Fe(OH)3+4CO2
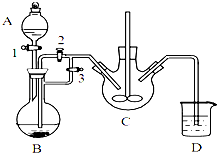
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如图:
回答下列问题:
(1)NH4HCO3盛放在装置中(填字母),该装置中涉及的主要反应的离子方程式Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是关闭活塞3,打开活塞2.
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应.铁粉的作用是.反应结束后,无需过滤,除去过量铁粉的方法是加入适量乳酸让铁粉反应完全.
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化.
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量.取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500mol•L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.70mL.滴定反应如下:Ce4++Fe2+═Ce3++Fe3+则产品中乳酸亚铁的质量分数为98.5%.
分析 (1)(2)亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;
(3)实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉用乳酸除去,Fe被充分利用;
(4)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大;根据离子方程式计算20mL溶液中n(Fe2+),进而计算100mL含有n(Fe2+),再根据m=nM计算乳酸亚铁晶体的质量,进而计算产品中乳酸亚铁晶体的质量分数.
解答 解:亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;
(1)由上述分析可知,NH4HCO3盛放在装置C中,该装置中涉及的主要反应的离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:C;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2;
故答案为:关闭活塞3,打开活塞2;
(3)Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,加入适量乳酸让铁粉反应完全,
故答案为:防止Fe2+离子被氧化;加入适量乳酸让铁粉反应完全;
(4)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.05000mol/L×0.0197L=0.000985mol,故100mL含有n(Fe2+)=0.000985mol×$\frac{100}{20}$=0.004925mol,故产品中乳酸亚铁晶体的质量分数为$\frac{0.004925×288}{1.44}$×100%=98.5%,
故答案为:乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化;98.5%.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,难度较大.

| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.(1)①氯胺(NH2Cl)的电子式为
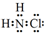 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s)?N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=0.003mol•L-1•min-1.
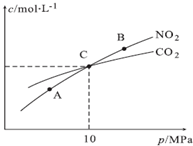
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)(填“<”或“>”或“=”).
②A、B、C三点中NO2的转化率最高的是A(填“A”或“B”或“C”)点.
Ⅰ.制备TiCl4
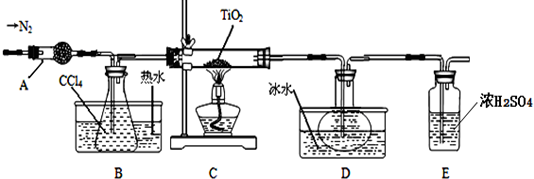
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行.
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(4)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(5)一定条件下,将TiO2溶解并还原为Ti3+,用FeCl3标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 FeCl3标准溶液20mL.
①配制FeCl3标准溶液时,要加入一定量的盐酸,其目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
(一)合成:
方案甲:采用装置甲,在烧瓶中加入11.5mL正丁醇、7.2mL冰醋酸、3~4滴浓硫酸和沸石,摇匀.安装好带分水器的回流反应装置,通冷却水,加热.在反应过程中通过分水器下部的旋塞分出生成的水.反应基本完成后,停止加热.
方案乙:采用装置乙,加料方式与方案甲相同.加热回流,反应60min后停止加热.

(二)提纯:甲乙两方案提纯方法均如下:

回答下列问题:
(1)a处水流方向是进水(填“进水”或“出水”),仪器b的名称(直形)冷凝管.
(2)合成步骤中,判断方案甲酯化反应已基本完成的标志是分水器中水不再生成或分水器中的水层不再增加时.
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断;步骤③的目的是除去溶于酯中的少量无机盐.
(4)下列有关洗涤过程中分液漏斗的使用正确的是BC(选填序号).
a.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
b.洗涤时振摇放气操作应如图戊所示
c.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
d.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中
(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,则收集到的产品馏分中还含有正丁醇.
(6)实验中乙酸丁酯产率较高的方案是方案甲,理由是通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |
| A. | C60 | B. | C2H6O | C. | C3H8 | D. | C2H5NO2 |
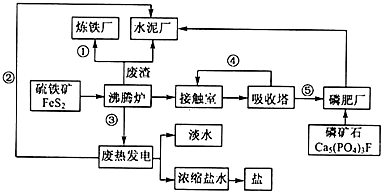 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.