题目内容
4.已知NaH是一种白色晶体,离子化合物.其中的H-离子有很强的还原性,金属钛容易溶解于氢氟酸、浓硫酸、浓盐酸和王水中,工业上常用NaH在高温下将TiCl4还原成Ti.试写出上述反应方程式TiCl4+4NaH=Ti+4NaCl+2H2↑.分析 NaH中Na为+1价,则H为-1价,为最低价态,可被氧化,具有还原性,氢化钠在高温下将TiCl4还原为Ti,自身被氧化为0价,根据得失电子守恒和原子守恒书写方程式.
解答 解:NaH中Na为+1价,则H为-1价,为最低价态,可被氧化,具有还原性,TiCl4中的Ti为+4价,具有氧化性,氢化钠在高温下将TiCl4还原为Ti,自身被氧化为0价,则应生成H2,根据得失电子守恒,NaH前系数为4,TiCl4,前系数为1,根据原子守恒,反应的方程式为TiCl4+4NaH=Ti+4NaCl+2H2↑,
故答案为:TiCl4+4NaH=Ti+4NaCl+2H2↑.
点评 本题考查方程式的书写,根据题干信息写出反应物和生成物是解答关键,题目较简单

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.实验室用锌与稀硫酸反应制取H2,欲使产生H2的速率加快,下列措施可行的是( )
| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 改用98%的浓硫酸 | D. | 锌片改为锌粒 |
9.常温下,某溶液中由水电离产生的c(OH-)、c(H+)满足c(OH-)•c(H+)=10-24,下列各组离子在溶液中可能大量共存的是( )
| A. | Mg2+、NO3-、K+、Cl- | B. | Fe2+、NO3-、Al3+、Cl- | ||
| C. | Mg2+、SO42-、Na+、HCO3- | D. | K+、NH4+、AlO2-、SO42- |
16.下列各组有机物中,仅使用溴水不 能鉴别出的是( )
| A. | 苯和四氯化碳 | B. | 乙醇和乙酸 | C. | 乙烷和乙烯 | D. | 苯和酒精 |
13.下列反应可用于设计原电池的是( )
| A. | CO2+2H2O═CH4+2O2 | B. | NaOH+HCl═NaCl+H2O | ||
| C. | 4Al+3O2+6H2O═4Al(OH)3 | D. | Cu+2HCl═CuCl2+H2↑ |

 .
.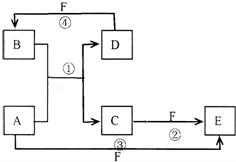 已知A、B、C、D、E、F六种物质的转化关系如图所示 (反应条件和部分产物未标出)
已知A、B、C、D、E、F六种物质的转化关系如图所示 (反应条件和部分产物未标出) ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.