题目内容
1.在50mL 9mol/L的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)=3mol/L.(1)则生成的气体中NO2的物质的量为0.125 mol.
(2)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH═2NaNO2+H2O
2NO2+2NaOH═NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1mol/L的NaOH恰好被吸收,NaOH溶液的体积为150 mL.
分析 (1)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-),令NO2、NO的物质的量分别为xmol、ymol,利用电子转移守恒、二者的物质的量之和列方程计算.
(2)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO),根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3),再根据V=$\frac{n}{c}$计算.
解答 解:(1)6.4g Cu的物质的量=$\frac{6.4g}{64g/mol}$=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-)=0.05L×9mol/L=0.45mol-0.1L×3mol/L=0.15mol,
令NO2、NO的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.15}\\{x+y=0.15\\;x+3y=0.1×2}\end{array}\right.$,
解得x=0.125,y=0.025.
故答案为:0.125;
(2)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL.
故答案为:150.
点评 本题考查了氧化还原反应的有关计算,根据原子守恒、电荷守恒来分析解答,难度中等.

练习册系列答案
相关题目
19.设NA为阿伏伽德罗常数,下列说法一定正确的是( )
| A. | 4g D2和足量O2反应可生成D2O 2NA个 | |
| B. | 98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 | |
| C. | 6.02×1023个葡萄糖分子约含羟基6NA个 | |
| D. | 1molNa完全燃烧可转移电子NA个 |
12.碘酸钙[Ca(IO3)2]既能补碘又能补钙的新型食品和饲料添加剂.碘酸钙可通过下列途径合成.
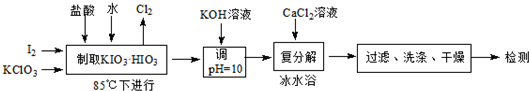
(1)若称取的I2质量为3.810g,为使I2充分氧化,则投料时KClO3的质量至少为3.675;同时生成的氯气体积为336mL(标准状况).
(2)用KOH溶液调节pH的目的是将KIO3•HIO3转变为KIO3.
(3)已知几种盐的溶解度(g/100g水)如下:
碘酸钙的物理性质
复分解时,采用冰水浴的目的是减小Ca(IO3)2在水中的溶解度,使其充分析出;此时所得产品的化学式为Ca(IO3)2•6H2O.
(4)准确称取产品0.6000g于烧标中,加1:1高氯酸20mL,微热溶解后,冷却,配成250.00mL溶液.移取上述溶液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL、3gKI(足量)(发生:IO3-+5I-+6H+═3I2+3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入0.3%淀粉溶液2mL,用0.1000mol•L-1Na2S2O3溶液滴定(发生:I2+2S2O32-═2I-+S4O62-)到终点时消耗12.00mL,试计算产品中Ca(IO3)2的质量分数(给出计算过程).

(1)若称取的I2质量为3.810g,为使I2充分氧化,则投料时KClO3的质量至少为3.675;同时生成的氯气体积为336mL(标准状况).
(2)用KOH溶液调节pH的目的是将KIO3•HIO3转变为KIO3.
(3)已知几种盐的溶解度(g/100g水)如下:
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
(4)准确称取产品0.6000g于烧标中,加1:1高氯酸20mL,微热溶解后,冷却,配成250.00mL溶液.移取上述溶液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL、3gKI(足量)(发生:IO3-+5I-+6H+═3I2+3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入0.3%淀粉溶液2mL,用0.1000mol•L-1Na2S2O3溶液滴定(发生:I2+2S2O32-═2I-+S4O62-)到终点时消耗12.00mL,试计算产品中Ca(IO3)2的质量分数(给出计算过程).
9.福岛核电站泄漏的放射性物质中含有$\stackrel{131}{53}$I,下列有关$\stackrel{131}{53}$I的说法正确的是( )
| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | $\stackrel{131}{53}$I是碘元素的一种同位素 | |
| C. | $\stackrel{131}{53}$I核素中含中子数为53 | |
| D. | $\stackrel{131}{53}$I2的摩尔质量为262 g |
13.光纤通讯是光作为信息的载体,让光在光导纤维中传输,制造光导纤维的基本原料是( )
| A. | Cu | B. | Si | C. | SiO2 | D. | Al2O3 |
10.导致酸雨和加剧温室效应的主要原因是( )
| A. | 大量砍伐森林 | B. | 大量燃烧煤和石油等化石燃料 | ||
| C. | 水土流失 | D. | 汽车排放尾气剧增 |
11. T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
 T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2 mol/(L•min) | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应放热反应 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 曲线Ⅱ对应的条件改变是加入催化剂 |