题目内容
6.某校化学探究小组学生进行如下实验,以验证甲酸分子中含有醛基,并探究其酯化反应的性质.实验I:银镜反应
(1)进行银镜反应前,必须在其中加入一定量的NaOH溶液,因为反应必须在碱性条件下发生.
(2)甲酸进行银镜反应的化学方程式HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O.
(3)该小组成功地完成了银镜反应,他们肯定没有进行的操作(填序号,多选)BCD.
A.用洁净的试管;
B.在浓度为2%的NH3•H2O中滴入稍过量的浓度为2%的AgNO3溶液;
C.用前几天配制好的银氨溶液; D.用小火对试管直接加热;
实验II:酯化反应
该小组同学设计了甲、乙两套实验装置,对甲酸与甲醇进行了酯化反应的研究:
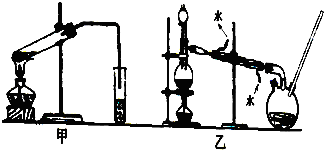
(4)装置乙中长导管的作用是冷凝回流甲醇,平衡内外大气压强.
(5)甲酸和甲醇(CH318OH)进行酯化反应的化学方程式HCOOH+CH318OH$?_{△}^{浓H_{2}SO_{4}}$HCO18OCH3+H2O.
(6)甲装置还是乙装置好?乙,其原因是冷凝效果好,减少了甲醇等有毒物质对大气的污染.
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有饱和碳酸钠溶液、碎瓷片(沸石)两种必备用品.
(8)某同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释:NaOH溶液的碱性较强,甲酸甲酯在NaOH溶液中发生水解.
分析 (1)银镜反应的条件是在碱性条件下发生;
(2)能发生银镜反应的物质必含有醛基官能团,甲酸含有醛基,可以发生银镜反应;
(3)依据银镜反应的实验操作和注意问题分析判断;
(4)依据实验装置,实验过程,反应的原理产物性质分析;
(5)依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
(6)根据甲醇性质分析,甲醇是有毒的易挥发的有机物;
(7)根据甲酸、甲醇的性质和饱和碳酸钠的作用解答;
(8)根据酯在碱溶液中水解生成酸盐和醇分析判断.
解答 解:(1)银镜反应的条件是在碱性条件下发生,在甲酸进行银镜反应前,必须在其中加入一定量的碱,可以加NaOH溶液,
故答案为:NaOH溶液;反应必须在碱性条件下发生;
(2)甲酸含有醛基,能发生银镜反应,发生反应HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O,
故答案为:HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O;
(3)银镜反应的条件是在碱性条件下发生的,是在新制的银氨溶液中加入少量需要检验的有机物,水浴加热,生成银镜现象,反应过程中不能震荡,试管要洁净,银氨溶液需要新制,制备方法是想硝酸银溶液中加入氨水,生成沉淀,继续加入到沉淀恰好溶解得到银氨溶液,所以成功的做了银镜反应,
A、用洁净试管使银析出均匀,故A需要;
B、在浓度为2%的NH3•H2O中滴入稍过量的浓度为2%的硝酸银,滴加试剂顺序错误,需碱过量,故B不需要;
C、久置的银氨溶液会析出氮化银、亚氨基化银等爆炸性沉淀物,易反应危险.故C不需要;
D、为得到均匀的银镜,需要用水浴加热,故D不需要;
故答案为:BCD;
(4)乙装置中长导管A的作用是冷凝回流甲醇,平衡内外大气压强,
故答案为:冷凝回流甲醇,平衡内外大气压强;
(5)甲酸和甲醇进行酯化反应的历程是羧酸脱羟基醇脱氢,反应化学方程式为:HCOOH+CH318OH$?_{△}^{浓H_{2}SO_{4}}$HCO18OCH3+H2O,
故答案为:HCOOH+CH318OH$?_{△}^{浓H_{2}SO_{4}}$HCO18OCH3+H2O;
(6)甲醇是有毒的易挥发的有机物,需要密封装置中进行,所以选择乙,冷凝效果好,减少了甲醇等有毒物质对大气的污染,
故答案为:乙;冷凝效果好,减少了甲醇等有毒物质对大气的污染;
(7)甲酸和甲醇沸点低,易挥发,需用碎瓷片(沸石),为了降低了甲酸甲酯的溶解度,同时还能除去混有的甲醇和甲酸,需用饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;碎瓷片(沸石);
(8)用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,是因为甲酸甲酯在NaOH溶液中发生水解,生成甲酸钠和甲醇,得不到酯,
故答案为:NaOH溶液的碱性较强,甲酸甲酯在NaOH溶液中发生水解.
点评 本题考查了有机物性质的应用、实验操作的步骤、注意问题、试剂选择、反应现象、装置的分析等,掌握醛基检验的实验方法判断,装置的原理应用是解答的关键,题目难度中等.


已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7
D氨水 E氢氧化锶粉末 F碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.

(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、⑥后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4,KNO3 | ⑦SO2 ⑧SO3 | ⑨NH3 |
(4)写出①与③发生中和反应离子方程式H++OH-=H2O.
(5)写出实验室制备⑨的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2.
(6)硝酸的摩尔质量是63g/mol.3.4g氨气是0.2mol;分子数是0.2NA个;含氢原子0.6mol.在标准状况下,4.48L CO2是与6.4g O2的物质的量相等.
| A. | 2,2-二甲基丁烷 | B. | 3-甲基-1-丁炔 | ||
| C. | 3-甲基-2-戊烯 | D. | 3,3-二甲基-2-戊烯 |
 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )| A. | Na2O2中阴阳离子数目之比为1:2 | |
| B. | 反应①的离子方程式为:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 反应③最多能产生0.05 mol O2 | |
| D. | ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.