题目内容
下列有关活化分子的说法正确的是( )
| A、增大反应物浓度可以提高活化分子百分数 |
| B、升高温度能提高活化分子百分数 |
| C、使用合适的催化剂可以增大活化分子的能量 |
| D、增大体系的压强一定能提高活化分子百分数 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:增大压强、浓度,单位体积活化分子的数目增多,升高温度、加入催化剂活化分子的百分数增大,能发生化学反应的碰撞是有效碰撞,以此解答.
解答:
解:升高温度、加入催化剂能提高活化分子百分数,且加入催化剂可降低反应的活化能;
增加反应物浓度,增大体系压强只增大单位体积活化分子的数目,百分数不变;
只有B正确,
故选B.
增加反应物浓度,增大体系压强只增大单位体积活化分子的数目,百分数不变;
只有B正确,
故选B.
点评:本题考查影响活化分子的因素,为高频考点,侧重于学生的分析能力的考查,注意相关知识的积累,学习中注意温度、浓度、压强、催化剂对反应速率的影响的根本原因是影响活化分子的浓度或百分数,难度不大.

练习册系列答案
相关题目
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A、图中AB段的氧化剂为K2Cr2O7 |
| B、图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C、开始加入的K2Cr2O7为0.25 mol |
| D、K2Cr2O7可与FeSO4反应的物质的量为1:3 |
A、B、C、D 为4种金属.将A、B分别加入等浓度稀盐酸中,B比A反应更剧烈.将A、D用导线连结,同时浸入稀硫酸中,D表面出现大量气泡.将D浸入C的盐溶液中,有C析出.则其金属活动性由强到弱的顺序是( )
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
下列实验方案设计合理且能达到相应实验预期目的是( )
A、 制取少量蒸馏水 |
B、 用铜和浓硝酸制取少量NO2 |
C、 证明氧化性:Cl2>Br2>I2 |
D、 制取HCL且除去多余的气体 |
下列有关实验操作正确的是( )
A、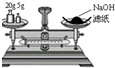 称量氢氧化钠固体 |
B、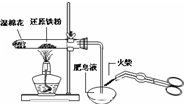 检验铁粉与水蒸气反应产生的氢气 |
C、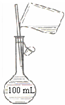 配制150 mL 0.10 mol/L盐酸 |
D、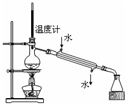 分离两种互溶但沸点相差较大的液体混合物 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
A、1L1mol/L的Na2CO3溶液中含CO
| ||
| B、100mL 10mol/L的浓硝酸与足量铜反应,硝酸得到的电子数为0.5NA | ||
| C、常温下100mL0.1mol/L醋酸溶液中含醋酸分子0.01NA | ||
| D、0.1molNa2O2与足量水反应转移电子数0.1NA |
目前人们正研究开发一种高能电池--钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β″Al2O3陶瓷作固体电解质,反应为2Na+xS
Na2Sx.以下说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,硫作负极,电极反应式为:xS+2e-=Sx2- |
| B、放电时,电池中消耗4.6g Na,反应中转移1.204×1023个电子 |
| C、该反应一定是一个自发进行的吸热反应 |
| D、放电时,电子从钠极经外电路流向到硫极,再从硫极经内电路流向钠 |
将一定量氯化钙溶于90g水中,欲使每100个水分子中含有1个Cl-,这一定量的氯化钙是( )
| A、0.3mol |
| B、0.025mol |
| C、0.05mol |
| D、5.55g |
下列食品添加剂与类别对应正确的一组是( )
| A、着色剂-----醋酸 |
| B、疏松剂-----碳酸氢钠 |
| C、调味剂------亚硝酸钠 |
| D、防腐剂------苯甲酸钠 |