题目内容
7.在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”.凡具有一个手性碳原子的化合物一定具有光学活性.例如,有机物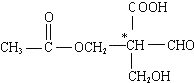 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )| A. | 与NaOH溶液共热 | B. | 与银氨溶液共热 | ||
| C. | 与金属钠反应 | D. | 与氢气发生加成反应 |
分析 经过反应仍具有光学活性,说明反应后得到物质中含有手性碳原子,反应后的生成物中存在碳原子上连接4个不同的原子或原子团,结合反应后产物结构判断.
解答 解: 具有光学活性是由于连接羧基的碳原子为手性碳原子.
具有光学活性是由于连接羧基的碳原子为手性碳原子.
A.与NaOH水溶液反应后得到 、CH3COOH,均没有手性碳原子,均没有光学活性,故A错误;
、CH3COOH,均没有手性碳原子,均没有光学活性,故A错误;
B.与银氨溶液作用只发生银镜反应,-CHO转化为-COOH,连接羧基的碳原子不再是手性碳原子,没有光学活性,故B错误;
C.羧基、醇羟基能与钠反应,反应后连醛基的碳原子仍是手性碳原子,具有光学活性,故C正确;
D.催化剂作用下与H2加成,-CHO转化为-CH2OH,连接羧基的碳原子同时又连接2个-CH2OH,不再是手性碳原子,没有光学活性,故D错误.
故选:C.
点评 本题考查有机物的结构与性质、手性碳原子等,注意理解手性碳原子与光学活性,熟练掌握官能团的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.能正确表示下列反应的离子方程式的是( )
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
15. A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:H-C≡C-H.
(2)写出E元素的元素符号:Co,其价电子排布图为: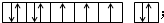 .
.
(3)A与D形成化合物的化学式为BCl3,是非极性分子(填“极性”或“非极性”)
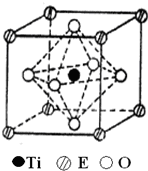
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为6个、12个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为直线形,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是NH3和N3-,E的配位数是6.
 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:Co,其价电子排布图为:
 .
.(3)A与D形成化合物的化学式为BCl3,是非极性分子(填“极性”或“非极性”)
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为6个、12个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为直线形,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是NH3和N3-,E的配位数是6.
2.绿色电源“二甲醚【(CH3)2O】-氧气燃料电池”的工作原理如图所示,下列说法正确的是( )
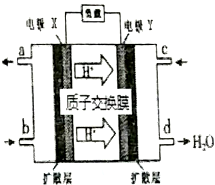

| A. | 氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O═4OH- | |
| B. | 电池在放电过程中,电极X周围溶液的pH增大 | |
| C. | 当该电池向外电路提供2 mol电子时消耗O2约为11.2L | |
| D. | 二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O═2CO2+12H+ |
19.下列有机物的名称错误的是( )
| A. | 1,1,2,2-四溴乙烷 | B. | 2-甲基-3-丁烯 | ||
| C. | 3-乙基戊烷 | D. | 2,4,6-三硝基甲苯 |
16.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂.下列说法正确的是( )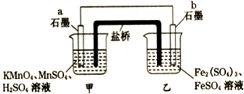

| A. | b电极上发生的反应:Fe2+-e-═Fe3+ | |
| B. | a电极上发生氧化反应:MnO4-+8H++5e-═Mn2++4H2O | |
| C. | 外电路电子的流向是从a到b | |
| D. | 电池工作时,盐桥中的SO42-移向甲烧杯 |
17.甲醛的分子式为CH2O,常温下是气体,有毒.下列分析正确的是( )
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |