题目内容
16.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂.下列说法正确的是( )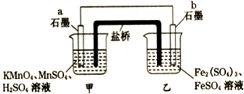
| A. | b电极上发生的反应:Fe2+-e-═Fe3+ | |
| B. | a电极上发生氧化反应:MnO4-+8H++5e-═Mn2++4H2O | |
| C. | 外电路电子的流向是从a到b | |
| D. | 电池工作时,盐桥中的SO42-移向甲烧杯 |
分析 由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
解答 解:A、b为负极,负极发生氧化反应,Fe2+-e-═Fe3+,故A正确;
B、a电极中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,故B错误;
C、由上述分析可知,a为正极,电子由负极流向正极,即从b流向a,故C错误;
D、阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故D错误;
故选A.
点评 本题考查原电池的工作原理及常见的化学电源,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
6.下列各组物质中,关系不正确的是( )
| A. | C3H8与C2H6互为同系物 | |
| B. | 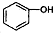 与 与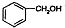 互为同系物 互为同系物 | |
| C. | 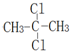 和 和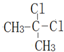 是同一种物质 是同一种物质 | |
| D. | 化学式为C5H10的有机物不一定能使溴的四氯化碳溶液褪色 |
7.在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”.凡具有一个手性碳原子的化合物一定具有光学活性.例如,有机物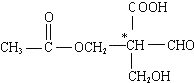 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )| A. | 与NaOH溶液共热 | B. | 与银氨溶液共热 | ||
| C. | 与金属钠反应 | D. | 与氢气发生加成反应 |
11.下列有关化学用语使用正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | CO2分子的结构式:O=C=O | ||
| C. | 过氧化氢的电子式: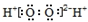 | D. | 四氯化碳分子比例模型: |
1.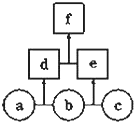 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )| A. | d和e分子中所有原子都不满足8电子结构 | |
| B. | 单质c的氧化性强于单质a | |
| C. | 相同状况下,单质c、a、b的沸点逐渐减小 | |
| D. | f可电离生成两种含10个电子的离子 |
8.下列说法中正确的是( )
| A. | 因为p轨道是“8”字形的,所以p电子走“8”字形 | |
| B. | 第三电子层,有3s、3p、3d三个轨道 | |
| C. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| D. | 一般情况下,σ键比π键重叠程度大,形成的共价键强 |
5.下列各组混合物,能用分液的方法分离的是( )
| A. | 氯化钠和泥沙 | B. | 汽油和柴油 | C. | 四氯化碳和水 | D. | 氯化钙和硫酸钡 |
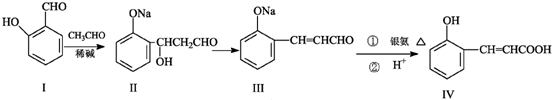
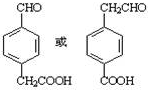 .
. 合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.