题目内容
 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=| c(CO2) |
| c(CO) |
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值
(2)1100℃时测得高炉中c(CO2)=0.025mol?L-1、c(CO)=0.1mol?L-1,在这 种情况下,该反应是否处于化学平衡状态
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②若改变条件使平衡向正反应方向移动,则平衡常数
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能.
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)升高温度平衡向吸热方向移动,根据平衡移动的方向判断高炉内CO2和CO的体积比值变化以及平衡常数K值;
(2)反应是吸热反应,计算浓度商,与平衡常数比较,可判断反应是否达到平衡状态并判断反应进行的方向;
(3)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=
计算v(H2);
②根据化学平衡常数的影响因素判断.
(2)反应是吸热反应,计算浓度商,与平衡常数比较,可判断反应是否达到平衡状态并判断反应进行的方向;
(3)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=
| △c |
| △t |
②根据化学平衡常数的影响因素判断.
解答:
解:(1)化学反应是吸热反应,温度升高,化学平衡正向进行,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值增大;依据化学平衡常数概念和计算式判断平衡常数增大,
故答案为:增大;增大;
(2)1100℃时测得高炉中c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,在这种情况下,难度商Qc=
=
=0.25<K=0.263,所以此时反应未达到化学平衡,反应正向进行,正反应速率大于逆反应速率;故答案为:否;大于;
(3)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
=0.225mol/(L?min),
故答案为:0.225mol/(L?min);
②化学平衡常数只与温度有关,当不改变温度,使平衡向右移动时,化学平衡常数不变,正反应放热,当降低温度使平衡向右移动时,化学平衡常数减小,故答案为:ac.
故答案为:增大;增大;
(2)1100℃时测得高炉中c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,在这种情况下,难度商Qc=
| c(CO2) |
| c(CO) |
| 0.25mol/L |
| 0.1mol/L |
(3)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
| 2.25mol/L |
| 10min |
故答案为:0.225mol/(L?min);
②化学平衡常数只与温度有关,当不改变温度,使平衡向右移动时,化学平衡常数不变,正反应放热,当降低温度使平衡向右移动时,化学平衡常数减小,故答案为:ac.
点评:本题考查了化学平衡常数的计算判断,关键理解平衡常数是随温度变化,平衡常数的计算应用,浓度商和平衡常数比较判断反应是否平衡,反应进行的方向,题目难度中等.

练习册系列答案
相关题目
 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题: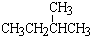 ; ⑧CH3CH2CH2CH3与CH3CH(CH3)2
; ⑧CH3CH2CH2CH3与CH3CH(CH3)2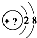 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.