题目内容
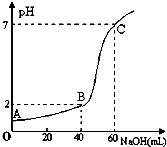 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、A、B、C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.设出盐酸和氢氧化钠溶液的物质的量浓度,然后根据图象中数据列式计算出盐酸和氢氧化钠溶液的浓度;
B.根据B点盐酸过量判断溶液中各离子的浓度大小;
C.A、B为酸性溶液,抑制了水的电离,氢离子浓度越大,水的电离程度越小,C点为中性,A、B、C中C点水的电离程度最大;
D.锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大,消耗的标准液体积偏大,测定结果偏高.
B.根据B点盐酸过量判断溶液中各离子的浓度大小;
C.A、B为酸性溶液,抑制了水的电离,氢离子浓度越大,水的电离程度越小,C点为中性,A、B、C中C点水的电离程度最大;
D.锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大,消耗的标准液体积偏大,测定结果偏高.
解答:
解:A.设HCl的浓度是x mol/L,NaOH溶液浓度为y mol/L,结合图象则有:①20×10-3×x=60×10-3×y,②20×10-3×x-40×10-3×y=0.01×(20+40)×10-3,根据①②解得:x=0.09,y=0.03,即HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1,故A正确;
B.在B点,盐酸过量,氢氧化钠溶液不足,溶液显酸性,则c(OH-)<c(H+),溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.在A、B、C三点溶液的酸性依次减弱,水的电离程度依次增大,则水的电离程度大小依次为:C>B>A,故C错误;
D.滴定前,锥形瓶用待测液润洗,导致溶液中氢离子的物质的量增加,滴定过程中消耗n(NaOH)增大,测定的HCl浓度偏高,故D错误;
故选A.
B.在B点,盐酸过量,氢氧化钠溶液不足,溶液显酸性,则c(OH-)<c(H+),溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.在A、B、C三点溶液的酸性依次减弱,水的电离程度依次增大,则水的电离程度大小依次为:C>B>A,故C错误;
D.滴定前,锥形瓶用待测液润洗,导致溶液中氢离子的物质的量增加,滴定过程中消耗n(NaOH)增大,测定的HCl浓度偏高,故D错误;
故选A.
点评:本题考查了酸碱混合后溶液的定性判断及溶液pH的简单计算、水的电离及其影响因素、溶液中离子浓度定性比较等知识,题目难度中等,注意掌握比较溶液中离子浓度大小的方法,明确溶液酸碱性对水的电离程度的影响,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
已知强酸和强碱在稀溶液中发生中和反应生成1molH2O(l)时放出57.30kJ热量,用500mL0.60mol/L
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
| A、68.76kJ |
| B、57.30 kJ |
| C、34.38kJ |
| D、17.19 kJ |
分子式为C6H12的烯烃与H2O的加成产物,不能发生催化氧化反应的有(不考虑立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
A、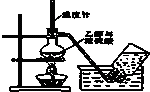 验室制取乙烯 |
B、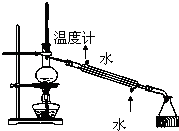 石油的分馏实验 |
C、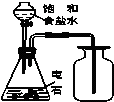 实验室制取乙炔并收集 |
D、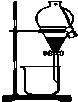 利用酒精萃取碘水中的I2单质 |
 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题: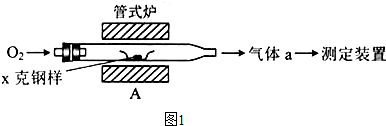
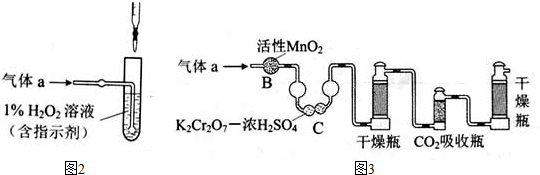
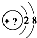 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.