��Ŀ����
5������˵����ȷ���ǣ�������| A�� | �����ȼ����Ϊ��H=-890.3 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-890.3 kJ/mol | |
| B�� | ��֪H2O��l���TH2O��g����H=+44 kJ/mol����2 g H2��g����ȫȼ������Һ̬ˮ��������̬ˮ���ͷ�22 kJ������ | |
| C�� | �����£���ӦC��s��+CO2��g���T2CO��g�������Է����У���÷�Ӧ�ġ�H��0 | |
| D�� | 1 mol NaOH�ֱ��1 mol CH3COOH��1 mol HNO3��Ӧ�����߱�ǰ�ߡ�HС |
���� A��ȼ������ָ1mol��������ȫȼ�������ȶ���������ų������������ɵ�ˮ����ΪҺ̬��
B��2g���������ʵ���Ϊ1mol��1mol������ȫȼ������1molˮ����2 g H2��g����ȫȼ������Һ̬ˮ��������̬ˮ���ͷ�44kJ��������
C����Ӧ�����Է���Ӧ�����G=��H-T•��S��0��
D���ʱ�Ϊ��ֵ����������ԽС���ʱ�Խ��ϴ��������Ҫ���ȷ�����
��� �⣺A�������ȼ����Ϊ��H=-890.3 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ������ˮ������Һ̬����ȷ���Ȼ�ѧ����ʽΪ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-890.3 kJ/mol����A����
B��H2O��l���TH2O��g����H=+44 kJ/mol��˵������ȼ������1molҺ̬ˮ��������̬ˮ��ų�44kJ��������2g���������ʵ���Ϊ��$\frac{2g}{2g/mol}$=1mol��1mol������ȫȼ������1molˮ����2 g H2��g����ȫȼ������Һ̬ˮ��������̬ˮ���ͷ�44kJ����������B����
C�����£���ӦC��s��+CO2��g��=2CO��g�������Է����У��÷�Ӧ�ġ�S��0����Ӧ�����Է������G=��H-T•��S��0�����ԡ�H��0����C����
D��1 mol NaOH�ֱ��1 mol CH3COOH��1 mol HNO3��Ӧ�������ڷ�Ӧ���������ȣ���������������Ʒ�Ӧ�ų�������С�����ʱ�Ϊ��ֵ������߱�ǰ�ߡ�HС����D��ȷ��
��ѡD��
���� ���⿼�����Ȼ�ѧ����ʽ����Ӧ�����ʱ��Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�Ȼ�ѧ����ʽ����дԭ��Ϊ���ؼ���ע�������жϷ�Ӧ�Է����еķ���������������ѧ�������Ӧ��������

| A | B | C | D | |
| �������� | ZnƬ��ʯī | CuƬ��FeƬ | FeƬ��ʯī | FeƬ��CuƬ |
| ������Һ | ϡ���� | Ũ HNO3 | FeCl3��Һ | �ƾ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
ij��ѧ��ȤС����ȡ����غ���ˮ�������й�̽��ʵ�顣
ʵ��һ ��ȡ����غ���ˮ��
������ͼ��ʾ��ʵ��װ�ý���ʵ�顣
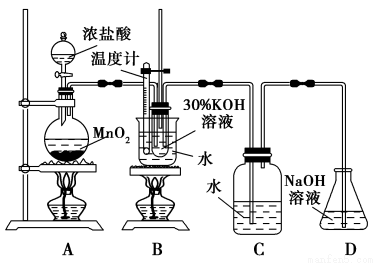
��1����ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˡ�ϴ�ӡ���ʵ�����������Ҫ�IJ���������________________��
��2�����Ե�B��Cװ�õ�λ�ã�___________(��ܡ��� �����ܡ�)���B������صIJ��ʡ�
ʵ��� �������⻯�ط�Ӧ��̽����
��3���ڲ�ͬ������KClO3�ɽ�KI����ΪI2��KIO3����С�������ϵ��ʵ���о���Ӧ�����Է�Ӧ�����Ӱ�죬����ϵ��aʵ��ļ�¼������(ʵ���������½���)��
�Թܱ�� | 1 | 2 | 3 | 4 |
0.20 mol��L��1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol��L��1 H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
����ˮ/mL | 9.0 | 6.0 | 3.0 | 0 |
ʵ������ |
��ϵ��aʵ���ʵ��Ŀ����______________________��
�����1���Թ�ʵ���������_____________________��
����2���Թ�ʵ������Ϊ����ɫ��Һ����ȡ��������Һ���������Һ����ɫ��������������Ψһ����ԭ����ΪKCl����˷�Ӧ�����ӷ���ʽΪ___________________��
ʵ���� �ⶨ������ˮ����Ԫ�ص�������
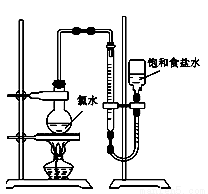
��4����С����Ƶ�ʵ�鷽��Ϊ��ʹ����ͼװ�ã�����15.0 mL������ˮ�������ⶨ���������������˷��������е���Ҫԭ����_____________��(������ʵ��װ�ü�����ʧ���²����е�ԭ��)
��5�������������ϣ�Ϊ��С�����һ�����е�ʵ�鷽��(���������������̵�ϸ��)�� _____________________��
���ϣ�i����������ƻ����ָʾ����ii��������������ɱ�SO2��H2O2��FeCl2�����ʻ�ԭ��Cl����

| A�� | Z������������ˮ������ǿ�� | |
| B�� | Y������������ˮ������һ��ǿ�� | |
| C�� | Z���Ӱ뾶��Yԭ�Ӱ뾶С | |
| D�� | Z����̬�⻯���Y����̬�⻯���ȶ� |
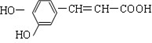
| A�� | ��������Է�����ԭ��ȡ�����Ӿ۵ȷ�Ӧ | |
| B�� | 1 mol���������������3 mol��NaHCO3 | |
| C�� | 1 mol���������4 mol H2 �����ӳɷ�Ӧ | |
| D�� | ��������FeCl3 ��Һ���Է�����ɫ��Ӧ |
| A�� | NH3 | B�� | KOH | C�� | H2SO4 | D�� | NaClO |
| A�� | ԭ����������������7 | B�� | �ۡ��е㣺F2��Cl2��Br2��I2 | ||
| C�� | ��F2��I2����ɫ���� | D�� | ��F2��I2������������ǿ |
