题目内容
10.设阿伏加德罗常数为 NA,则下列说法正确的是( )| A. | 常温常压下,1mol C nH 2n+2中所含有的共价键数目为(3n+1)N A | |
| B. | 14g 乙烯和丙烯的混合物中含有原子的数目为N A | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为 $\frac{5}{22.4}$NA | |
| D. | 1.5g 甲基(-CH 3)所含有的电子数是 N A |
分析 A、CnH2n+2中含n-1条C-C键,2n+2条C-H键;
B、乙烯和丙烯的最简式均为CH2;
C、标况下戊烷为液态;
D、求出甲基的物质的量,然后根据1mol甲基中含9mol电子来分析.
解答 解:A、CnH2n+2中含n-1条C-C键,2n+2条C-H键,故1molCnH2n+2中含(3n+1)NA条共价键,故A正确;
B、乙烯和丙烯的最简式均为CH2,故14g混合物中含CH2的物质的量为1mol,故含3NA个原子,故B错误;
C、标况下戊烷为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、1.5g甲基的物质的量为0.1mol,而1mol甲基中含9mol电子,故0.1mol甲基中含0.9NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
20.下列反应既能属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
1.下列各项所述的数字不是6的是( )
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在金刚石晶体中,围成最小环的原子数 | |
| C. | 在二氧化硅晶体中,围成最小环的硅原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数 |
18.14C可用于考古,“14”是指( )
| A. | 质量数 | B. | 核外电子数 | C. | 中子数 | D. | 质子数 |
5.A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子总数比A原子核外电子总数多5个电子,则A、B可形成的化合物为( )
| A. | A2B | B. | AB2 | C. | B2A3 | D. | B3A2 |
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55℃-60℃反应生成硝基苯 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 | |
| D. | 甲苯与溴蒸气在光照条件下反应主要生成邻溴甲苯和对溴甲苯 |
2.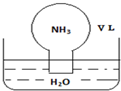 标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
 标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )| A. | 条件不足,不能计算所得溶液的物质的量浓度 | |
| B. | 所得溶液中,n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$ mol | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 水最终不可能充满整个烧瓶 |
20.下列说法中正确的是( )
| A. | 在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积不相同 | |
| B. | 分子式为C7H8O且属于酚类物质的同分异构体有4种 | |
| C. | 室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼 |
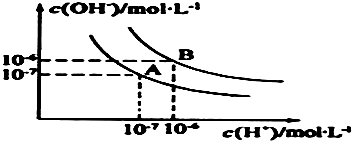 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: