题目内容
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 17gNH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LCl2与56gFe反应生成FeCl2分子的数目为NA | |
| C. | 7.0g丁烯含有C-H键的数目为NA | |
| D. | 常温下,1.0LpH=1的H2SO4溶液中,由水电离出的0H-的数目为0.1NA |
分析 A.气体物质的量n=$\frac{m}{M}$,1molNH3中含有的质子数10mol计算分析;
B.氯气是强氧化剂和铁反应生成氯化铁;
C.物质的量n=$\frac{m}{M}$,丁烯分子式为C4H8,1个丁烯分子中含8个C-H键;
D.常温下,1.0LpH=1的H2SO4溶液中,氢离子浓度=0.1mol/L,离子积常数计算得到溶液中氢氧根离子浓度,氢氧根离子浓度和水电离出的氢离子浓度相同;
解答 解:A.气体物质的量n=$\frac{m}{M}$=$\frac{17g}{17g/mol}$=1mol,1molNH3中含有的质子数10mol,则17gNH3中含有的质子数为10NA,故A正确;
B.氯气是强氧化剂和变价金属铁反应生成高价化合物氯化铁,无氯化亚铁生成,故B错误;
C.物质的量n=$\frac{m}{M}$=$\frac{7g}{56g/mol}$=0.125mol,丁烯分子式为C4H8,1个丁烯分子中含8个C-H键,则0.125mol丁烯含有C-H键的数目为0.125mol×8×NA=NA ,故C正确;
D.常温下,1.0LpH=1的H2SO4溶液中,氢离子浓度=0.1mol/L,离子积常数计算得到溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,常温下,1.0LpH=1的H2SO4溶液中,由水电离出的0H-的数目=10-13mol/L×1L=10-13NA,故D错误;
故选AC.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和微粒数、气体摩尔体积、溶液浓度等计算的分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
5.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插
入一支温度计,温度计的温度由20℃逐渐升至75℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
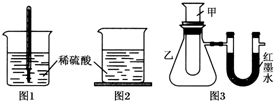
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是放热(填“吸热”或“放热”)反应,写 出该反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(2)方案一中,温度升至最大值后又下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(3)方案二中,小木片脱落的原因是蜡烛熔化,由此得出的结论是氢氧化钠与硫酸的反应放热.
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边低于(填“高于”“低于”或“等于”)右边.
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是红墨水液面左右相平.
(6)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插
入一支温度计,温度计的温度由20℃逐渐升至75℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.

方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
(1)铝片与稀硫酸的反应是放热(填“吸热”或“放热”)反应,写 出该反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(2)方案一中,温度升至最大值后又下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(3)方案二中,小木片脱落的原因是蜡烛熔化,由此得出的结论是氢氧化钠与硫酸的反应放热.
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边低于(填“高于”“低于”或“等于”)右边.
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是红墨水液面左右相平.
(6)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
6.下列离子或分子在水溶液中能大量共存,通入CO2后仍能大量共存的一组是( )
| A. | K+、Na+、Cl-、NO3- | B. | K+、Na+、Br-、SiO32- | ||
| C. | H+、Fe2+、SO42-、Cl2 | D. | K+、Ag+、NH3•H2O、NO3- |
3.相同温度下,pH和体积均相同盐酸和醋酸两种溶液,它们的( )
| A. | 溶液中溶质的物质的量相等 | B. | 溶液中的c(H+)相等 | ||
| C. | 与足量锌粉反应产生的H2量相等 | D. | 可以电离出来的n(H+)相等 |
10.已知某溶液中加入铝粉产生氢气,在此溶液中肯定能够大量共存的离子组是( )
| A. | SO32-、NO3-、Na+、K+ | B. | Na+、SO42-、Cl-、K+ | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、K+、AlO2-、SO42- |
7.有关原电池的下列说法中不正确的是( )
| A. | 电池负极发生氧化反应 | |
| B. | 一般相对活泼的金属材料做电池的负极 | |
| C. | 电子流向是从负极流向正极(外电路) | |
| D. | 阳离子移向负极(内电路) |
8.下列各项与化学平衡移动原理无关的是( )
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |